
【题目】按如图装置进行实验,下列推断正确的是
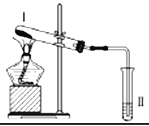
选项 | I中试剂 | II中试剂及现象 | 推断 |
A | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A.AB.BC.CD.D
【答案】A
【解析】
A. 酸性高锰酸钾溶液褪色说明石蜡油分解产生了使酸性高锰酸钾褪色的气态产物,则说明石蜡油蒸气在炽热碎瓷片的作用下,发生了化学变化,分解生成了不饱和烃,故A正确;
B. 品红溶液褪色说明FeSO4分解生成SO2,S元素的化合价从+6价降低为+4价,该反应为氧化还原反应,若FeSO4分解只生成FeO和SO2,则该反应中只有得电子,没有失电子,不符合氧化还原反应的规律,故B错误;
C. 氯化铵加热分解生成氨气和HCl,遇冷时氨气与氯化氢又能够化合生成氯化铵,所以酚酞溶液不变红色,故C错误;
D. 加热铁粉与水蒸气,气体受热膨胀,也能够使肥皂水冒泡,所以不能根据肥皂水冒泡得出铁粉与水蒸气发生了反应,故D错误;
故选A。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应:H2(g)+I2(g)![]() 2HI(g),达到化学平衡状态的标志是( )
2HI(g),达到化学平衡状态的标志是( )
A. 正、逆反应速率都等于零 B. H2、I2的浓度相等
C. HI、H2、I2在容器中共存 D. HI、H2、I2的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管新型二次电池的装置如图所示。下列说法中正确的是

A. 离子交换膜选用阳离子交换膜(只允许阳离子通过) B. 正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
C. 导线中通过1mol电子时,理论上负极区溶液质量增加1g D. 充电时,碳电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数为NA,下列叙述正确的是( )
A.10g氖气所含原子数为NA
B.在D218O中,质量数之和是质子数之和的两倍
C.28g由C2H4和C3H6组成的混合物中,H原子的数目为4NA
D.标况下22.4L正戊烷含氢原子数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃的结构简式为:![]() ,有甲、乙、丙、丁四位同学分别将其命名为:2-甲基-4-乙基-4-戊烯;2-异丁基-1-丁烯;2,4-二甲基-3-己烯;4-甲基-2-乙基-1-戊烯,下面对4位同学的命名判断正确的是
,有甲、乙、丙、丁四位同学分别将其命名为:2-甲基-4-乙基-4-戊烯;2-异丁基-1-丁烯;2,4-二甲基-3-己烯;4-甲基-2-乙基-1-戊烯,下面对4位同学的命名判断正确的是
A. 甲的命名主链选择是错误的
B. 乙的命名对主链碳原子的编号是错误的
C. 丙的命名主链选择是正确的
D. 丁的命名是正确的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含![]() 废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的
废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的![]() 和
和![]() 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
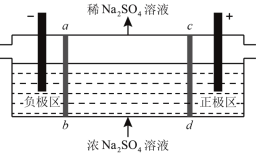
A.负极反应为2H2O-4e-=O2+4H+,负极区溶液![]() 降低
降低
B.通电后中间隔室的SO42-离子向正极迁移,正极区溶液![]() 增大
增大
C.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
D.当电路中通过1![]() 电子的电量时,会有1
电子的电量时,会有1![]() 的
的![]() 生成
生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为,苯分子的结构中碳碳间以单、双键交替排列结合成环状。为了验证凯库勒的观点,某同学设计了以下实验方案:

①按如图所示的装置连接好仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量FeBr3,塞上橡皮塞,打开止水夹K1、K2、K3;
④待烧瓶a中收集满气体后,将导管b的下端插入烧杯D里的水中,挤压预先盛有水的胶头滴管,观察实验现象。
(1)A中所发生反应的反应类型为________,能证明凯库勒观点错误的实验现象是________________________________________________________________。
(2)装置B的作用是___________________________________。
(3)装置A中发生反应的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于![]() 的说法错误的是
的说法错误的是
A.属于金属元素B.![]() 和
和![]() 是钇元素的两种同位素
是钇元素的两种同位素
C.原子的核外电子数为39D.质子数与中子数之差为50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是一种常用的消毒剂,易溶于水、易挥发、见光或受热易分解。其制备原理为:![]() △H<0,同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图。
△H<0,同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图。

(1)过氧乙酸保存时应注意______________(填标号)。
A.避光B.低温C.密闭D.隔绝空气
(2)仪器a的名称为______________,其中盛放的试剂为______________(填“乙酸”或“双氧水”)。
(3)为减少反应瓶中乙酸丁酯的损耗,反应开始前,在油水分离器中应进行的操作是______________。
(4)反应体系采用减压的目的是____。
(5)过氧乙酸(含有少量H2O2杂质)的含量测定流程如图。
![]()
①判断H2O2恰好除尽的实验现象是______________。
②过氧乙酸被Fe2+还原,还原产物之一为乙酸,其离子方程式为______________
③若样品体积为VomL,加入c1mol·L-1FeSO4溶液V1mL,消耗c2mol·L-1K2Cr2O7溶液V2mL。则过氧乙酸含量为______________g.L-l。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com