
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 在平衡3KSCN+FeCl3?Fe(SCN)3+3KCl的溶液中加入少量 KCl溶液 | 溶液红色变浅 | 增大c(KCl),平衡逆向移动 |
| B | 分别向盛有直馏汽油和裂化汽油的试管中加入几滴溴水 | 直馏汽油中溴水褪色,裂化汽油中溴水不褪色. | 可以用溴水鉴别直馏汽油和裂化汽油 |
| C | 向某卤代烃中加入稀NaOH溶液共煮几分钟,然后加入足量稀硝酸,再加入AgNO3溶液 | 产生黄色沉淀 | 该卤代烃中含碘原子 |
| D | 向油脂皂化反应后的溶液中滴入酚酞 | 溶液变红 | 油脂已经完全皂化 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.增大c(KCl),KCl不参加离子反应,不影响平衡移动;
B.裂化汽油中含有不饱和烃,直馏汽油不含不饱和烃;
C.卤代烃中卤元素检验时,用NaOH水溶液使卤代烃发生水解反应,然后加入稀硝酸中和未反应的NaOH,最后滴入硝酸银溶液,根据沉淀颜色确定卤元素;
D.油脂碱性条件下水解生成的高级脂肪酸盐溶液呈碱性.
解答 解:A.增大c(KCl),KCl不参加离子反应,不影响平衡移动,溶液颜色变浅是因为溶液体积增大使硫氰化铁浓度降低导致的,故A错误;
B.裂化汽油中含有不饱和烃,直馏汽油不含不饱和烃,所以直馏汽油中溴水不褪色,裂化汽油中溴水褪色,故B错误;
C.卤代烃中卤元素检验时,用NaOH水溶液使卤代烃发生水解反应,然后加入稀硝酸中和未反应的NaOH,最后滴入硝酸银溶液,根据沉淀颜色确定卤元素,该实验操作正确,能实现实验目的,故C正确;
D.油脂碱性条件下水解生成的高级脂肪酸盐溶液呈碱性,所以不能根据皂化后溶液酸碱性判断油脂是否完全皂化,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及卤代烃中卤元素检验、油脂水解、物质鉴别、化学平衡移动原理等知识点,明确实验原理、物质性质差异性是解本题关键,易错选项是A,注意:只有实际参加反应的离子或微粒浓度才能引起平衡移动,为易错点.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:实验题
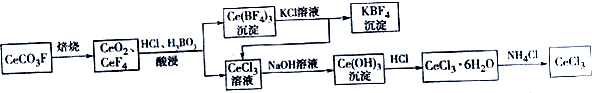
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO2 | C. | Cl2 | D. | O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3在该反应中作还原剂,被氧化 | |
| B. | Si3N4具有硬度大、熔点高,说明Si3N4可用作耐高温材料 | |
| C. | 标准状况下,22.4LNH3所含原子总数目为4×6.02×1023 | |
| D. | 该反应每生成1mol Si3N4转移电子总数目为12×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
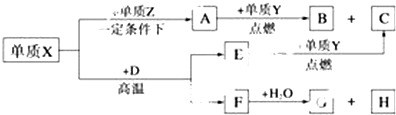
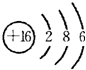 ,A的电子式
,A的电子式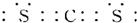 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com