
【题目】以苯为原料合成F,转化关系如下:
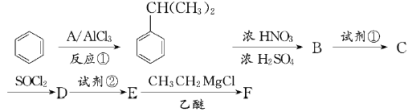
F是一种具有重要工业价值的芳香化合物,含有C、H、O、N四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,分子中有两个互为对位的取代基。C能与碳酸氢钠溶液反应,试剂②为Fe/HCl。
已知:① ;
;
②![]() (苯胺:弱碱性,易被氧化)
(苯胺:弱碱性,易被氧化)
③RCOCl![]() RCOR’
RCOR’
请回答下列问题:
(1)反应①为加成反应,写出A的化学式:_____________。
(2)B中所含官能团的名称为________;生成B时,常伴有副反应发生,反应所得产物除B外可能还含有____________________(写出一种产物的结构简式)。
(3)试剂①是_____________;试剂①和试剂②的顺序能否互换:________(填“能”或“不能”);为什么?_________________________________________________________。
(4)E生成F的化学方程式为__________________________________________________。
(5)参照上述合成路线,以(CH3)2CHCHO和CH3MgCl为原料(无机试剂任选),设计制备(CH3)2CHCOCH3的合成路线____________________________。
【答案】C3H6 硝基 
 酸性高锰酸钾 不能 先还原的氨基又会被后加入的酸性高锰酸钾氧化
酸性高锰酸钾 不能 先还原的氨基又会被后加入的酸性高锰酸钾氧化  +CH3CH2MgCl
+CH3CH2MgCl![]()
 +MgCl2 (CH3)2CHCHO
+MgCl2 (CH3)2CHCHO![]() (CH3)2CHCOOH
(CH3)2CHCOOH![]() (CH3)2CHCOCl
(CH3)2CHCOCl![]() (CH3)2CHCO CH3
(CH3)2CHCO CH3
【解析】
反应①为加成反应,苯和A反应生成异丙苯,则A为CH2=CHCH3,与苯发生加成反应生成异丙苯,反应为:CH2=CHCH3+![]()
催化剂 |
![]() ,异丙苯与浓硫酸、浓硝酸发生硝化反应,生成B,根据F是分子中有两个互为对位的取代基,则B为
,异丙苯与浓硫酸、浓硝酸发生硝化反应,生成B,根据F是分子中有两个互为对位的取代基,则B为 ,因胺基易被氧化,需先氧化烃基,再还原硝基,所以试剂①为酸性高锰酸钾溶液(KMnO4/H+),C为
,因胺基易被氧化,需先氧化烃基,再还原硝基,所以试剂①为酸性高锰酸钾溶液(KMnO4/H+),C为![]() ,与SOCl2反应,生成D
,与SOCl2反应,生成D![]() ,试剂②为Fe/HCl,E为:
,试剂②为Fe/HCl,E为:![]() ,与格氏试剂反应,生成F,格氏试剂与羰基发生加成反应,其中的“-MgBr”部分加到羰基的氧上,根据F是一种具有重要工业价值的芳香化合物,含有C、H、O、N 四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,式量为149,含有苯环,F为
,与格氏试剂反应,生成F,格氏试剂与羰基发生加成反应,其中的“-MgBr”部分加到羰基的氧上,根据F是一种具有重要工业价值的芳香化合物,含有C、H、O、N 四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,式量为149,含有苯环,F为![]() .以(CH3)2CHCHO为原料(无机试剂任选),设计制备(CH3)2CHCOCH3,因格氏试剂与羰基发生加成反应,若先与格氏试剂反应,产物经水解可得醇,得不到酮,所以需先氧化醛基,后与格氏试剂反应,制备(CH3)2CHCOCH3.
.以(CH3)2CHCHO为原料(无机试剂任选),设计制备(CH3)2CHCOCH3,因格氏试剂与羰基发生加成反应,若先与格氏试剂反应,产物经水解可得醇,得不到酮,所以需先氧化醛基,后与格氏试剂反应,制备(CH3)2CHCOCH3.
(1)反应①为加成反应,苯和A反应生成异丙苯,则A为CH2=CHCH3,与苯发生加成反应生成异丙苯,反应为:CH2=CHCH3+![]() 催化剂
催化剂![]() ,A的化学式为C3H6,
,A的化学式为C3H6,
故答案为:C3H6;
(2)异丙苯与浓硫酸、浓硝酸发生硝化反应,生成B,根据F是分子中有两个互为对位的取代基,则B为 ,所含官能团的名称为硝基,B含有两个互为对位的取代基,附反应产物在邻对位取代,所以反应所得产物除B外可能还含有
,所含官能团的名称为硝基,B含有两个互为对位的取代基,附反应产物在邻对位取代,所以反应所得产物除B外可能还含有 ,
,
故答案为:硝基; ;
;
(3)因胺基易被氧化,需先氧化烃基,再还原硝基,所以试剂①为酸性高锰酸钾溶液(KMnO4/H+),试剂①和试剂②的顺序不能互换,如果先还原后氧化,则还原生成的胺基又会被氧化,
故答案为:KMnO4/H+;如果先还原后氧化,则还原生成的胺基又会被氧化;
(4)E为:![]() ,与格氏试剂反应,生成F,格氏试剂与羰基发生加成反应,其中的“MgBr”部分加到羰基的氧上,根据F是一种具有重要工业价值的芳香化合物,含有C.H、O、N四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,式量为149,含有苯环,F为
,与格氏试剂反应,生成F,格氏试剂与羰基发生加成反应,其中的“MgBr”部分加到羰基的氧上,根据F是一种具有重要工业价值的芳香化合物,含有C.H、O、N四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,式量为149,含有苯环,F为![]() ,E生成F反应为:
,E生成F反应为:![]() ,
,
故答案为:![]() ;
;
(5)以(CH3)2CHCHO和CH3MgCl为原料(无机试剂任选),设计制备(CH3)2CHCOCH3,因格氏试剂与羰基发生加成反应,若先与格氏试剂反应,产物经水解可得醇,得不到酮,所以需先氧化醛基,制备(CH3)2CHCOCH3的合成路线为:![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
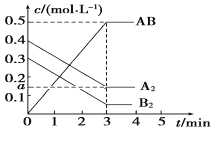
A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:

(1)10种元素中,第一电离能最大的是_______,电负性最小的金属元素是_____。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是__________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_____________。
(4)①和⑨的最高价氧化物对应水化物的化学式分别为_________、____________
(5)①和⑤的最高价氧化物对应水化物相互反应的离子方程式为______________________
(6)用电子式表示第三周期元素中由电负性最小的元素和电负性最大的元素形成化合物的过程:______________________________________
(7)⑨元素的价电子的轨道表示式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的不合理的是( )
A. 将废铁屑加入![]() 溶液中,可用于除去工业废气中的
溶液中,可用于除去工业废气中的![]()
B. 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多![]() 等)不利于作物生长,可施加熟石灰进行改良
等)不利于作物生长,可施加熟石灰进行改良
D. 无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________________________。
(2)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。
在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为__________________
,其离子方程式为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的离子关系正确的是( )
A.相同温度下,0.2 mol·L-1的醋酸溶液与0.l mol·L-1的醋酸溶液中c(H+)之比大于2 : 1
B.pH=3的醋酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等
C.0.l mol﹒L-1NaHSO4溶液中:c(H+)=c(SO![]() ) +c(OH-)
) +c(OH-)
D.pH=4、浓度均为0.l mol·L-1的CH3COOH、CH3COONa 混合溶液中:c(CH3COO-)-c(CH3COOH)=10-4-10-10mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于1L pH=3的H2SO4溶液说法正确的是
A.与等体积pH=11氨水混合后所得溶液pH小于7
B.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7
C.与pH=3的CH3COOH溶液混合后所得溶液pH小于3
D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
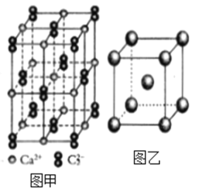
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com