
| A. | 电负性:He>F>O | B. | 第一电离能:O>N>P | ||
| C. | 离子半径:S2->Cl->Ca2+ | D. | 热稳定性:H2O>H2Se>H2S |
分析 A.非金属性越强,电负性越大;
B.非金属性越强,第一电离能越大,但N的p电子为半满稳定结构;
C.具有相同电子排布的离子,原子序数大的离子半径小;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.非金属性越强,电负性越大,则电负性为F>O>He,故A错误;
B.非金属性越强,第一电离能越大,但N的p电子为半满稳定结构,则第一电离能为N>O>P,故B错误;
C.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为S2->Cl->Ca2+,故C正确;
D.非金属性越强,对应氢化物越稳定,则热稳定性:H2O>H2S>H2Se,故D错误;
故选C.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
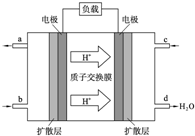 人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
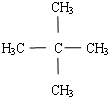 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②⑤⑦⑧ | C. | ①②③ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
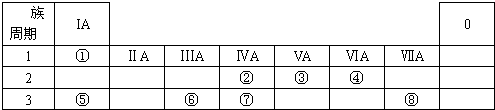
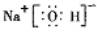 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)+$\frac{1}{2}$O2 (g)═CO2(g)△H=-283 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-802.3 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O (l)△H=-571.6 kJ/mol | |
| D. | H2 (g)+Cl2 (g)═2HCl (g)△H=-184.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑦ | B. | ①②④⑦ | C. | ②③④⑥ | D. | ②③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 用标准NaOH溶液测定食醋总酸含量时应该使用甲基橙作为指示剂 | |
| C. | 硫酸亚铁铵晶体制备实验的最后一步是将溶液蒸发到有大量晶体析出,用余热蒸干即可得产物 | |
| D. | 将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸,检验火柴头中是否含有氯元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com