
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒
B.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣个数为1NA
C.25℃,1.01×105Pa,11.2L Cl2含有的分子数小于0.5NA
D.常温下,23 g NO2含有2NA个氧原子
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:
【题目】物质的量浓度均为0.100mol/L的下列物质的溶液中,c(NH4+)最大的是( )
A.NH4ClB.NH4HSO4C.NH3·H2OD.CH3COONH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
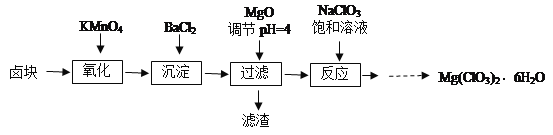
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
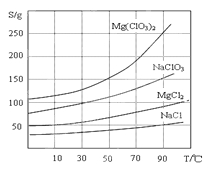
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。
回答下列问题:
(1)调pH时,加入MgO的原因___________。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?____________。
(3)加入NaClO3饱和溶液后发生反应的类型为_____________________________,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:蒸发浓缩、①______;②_____;③过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量4.00 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和30 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液30.00 mL。
①滴定时应用_____________(“酸式”或“碱式”)滴定管。步骤2中发生反应的离子方程式:_____________________________。
②产品中Mg(ClO3)2·6H2O的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI+5KIO3+3H2S=3I2+3K2SO4+3H2O,下列说法正确的是( )
A.氧化剂和还原剂物质的量之比为5:4
B.3 mol H2S可还原4mol的KIO3
C.I2是还原产物,K2SO4是氧化产物
D.1molKIO3可氧化0.2mol的KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于胶体的叙述错误的是
A.溶液显电中性,胶体带有电荷,所以胶体较稳定
B.胶体粒子能透过滤纸,但不能透过半透膜,所以可用渗析的的方法精制胶体
C.可用丁达尔效应区分溶液和胶体
D.电泳实验说明了胶体粒子能吸附溶液中的阳离子或阴离子而带有电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶液300mL,反应后溶液中SO42﹣的物质的量的浓度为( )(混合体积看成两液体体积之和)
A.0.4mol/L
B.0.3mol/L
C.0.2mol/L
D.0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
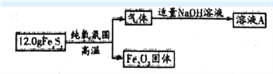
【题目】铁元素存在多种硫化物,兴趣小组为测定某铁硫化物(FeaSy)的组成按下列流程进行探究:
回答下列问题:
(1)测得Fe2O3固体的质量为8.0g,则FeaSy的化学式为______________。请设计实验检验Fe2O3中含有+3价铁:__________________________。
(2)铁硫化物在纯氧中发生反应的化学方程式为______________________________。
(3)兴趣小组同学推测溶液A中除含有Na2SO3外,还可能含有Na2SO4。设计实验方案并探究:
①用0.10 mol·L-1酸性KMnO4溶液应盛装在_______________(填“酸式“或“碱式”)滴定管中,然后进行滴定,反应的离子方程式为_________________________。
②确认A溶液中是否含有Na2SO4

请用化学方程式解释该方案不合理的原因____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)用PbS熔炼铅的过程中会有如下反应发生:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=a kJ·mol-1
PbS(s) +2O2(g) =PbSO4(s) △H=b kJ·mol-1
PbS(s) +2PbO(s) =3Pb(s) +SO2(g) △H=c kJ·mol-1
写出PbS与PbSO4反应生成Pb和SO2的热化学方程式____________________。
(2)利用电解法也可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。

a电极的名称是__________,b电极的电极反应式为______________________,该生产过程中可以循环利用的物质是____________________。
(3)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:Pb+PbO2+2H2SO4![]() 2PbSO4 +2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
2PbSO4 +2H2O。铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
(4)PbO2受热会随温度升高逐步分解。称取23.9g PbO2,将其加热分解,受热分解过程中固体质量随温度的变化如下图所示。

A点与C点对应物质的化学式分别为____________、_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的物质:①Cu; ②1molL﹣1的FeCl3溶液; ③CuCl2溶液;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧FeSO4
(1)以上物质中属于电解质的是;属于混合物的是 .
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入②的溶液,至液体呈透明的红褐色氢氧化铁胶体.则反应的化学方程式为;氢氧化铁胶体中分散质微粒的直径范围为nm;判断该胶体制备是否成功的方法是 .
(3)将②③⑧混合配制成浓度均为1molL﹣1的混合溶液100mL,加入一定量的铁粉,充分反应后,若铁粉无剩余,且有铜生成.则反应后的溶液中一定含有阳离子,可能含有阳离子,该阳离子在溶液中物质的量可能的存在范围是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com