

 键的物质的量为 mol。
键的物质的量为 mol。 键,4个N原子与Zn形成的配位键也是
键,4个N原子与Zn形成的配位键也是 键,所以l mol该配合物中含有
键,所以l mol该配合物中含有 键的物质的量为16mol。
键的物质的量为16mol。

科目:高中化学 来源:不详 题型:填空题
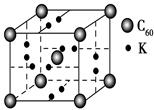
 则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 离能(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
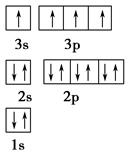
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:Y>Z>W |
| B.XW2熔点为-107°C,沸点为12.5°C,说明固态XW2为分子晶体 |
| C.YW3水溶液蒸干并灼烧可得YW3固体 |
D.ZW2分子结构见右图,说明ZW2是极性分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ”表示相关元素的原子中除去最外层电子的剩余部分,“
”表示相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com