
| 4.8g |
| 48g/mol |
| 5.6L |
| 22.4L/mol |
| 4.8g |
| 48g/mol |
| 5.6L |
| 22.4L/mol |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
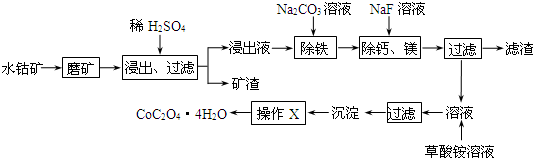
| c(Ca2+) |
| c(Mg2+) |
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
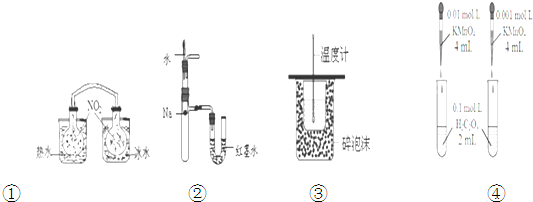
| A、装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)?N2O4(g)平衡移动的方向 |
| B、装置②依据U管两边液面的高低判断Na和水反应的热效应 |
| C、装置③测定中和热 |
| D、装置④依据褪色快慢比较浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中的c(CH3COO-) |
| B、溶液中的c(H+) |
| C、醋酸的电离平衡常数 |
| D、溶液中的c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取样,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、取样,加入硝酸银有白色沉淀,一定有Cl- |
| C、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、取样,滴加KSCN溶液,不显红色,再滴加氯水后显红色,一定有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com