
【题目】A、B、C、D、E、F六种原子序数依次增大的短周期元素.A与其余五种元素既不同周期,也不同主族;B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,其中B的单质为空气中的主要成分之一.
(1)A、B形成的化合物液态时可发生微弱电离,电离产生的阴离子的电子式为 .
(2)某含F的盐矿石的组成可以看作其氧化物中有 ![]() 的F被E替换,再由D平衡其电荷形成的.该矿石的化学式为 . (用氧化物形式表示)
的F被E替换,再由D平衡其电荷形成的.该矿石的化学式为 . (用氧化物形式表示)
(3)工业中制备单质E的阳极电极反应式: .
【答案】
(1)![]()
(2)MgO·Al2O3·6SiO2
(3)2O2﹣﹣4e﹣=O2↑
【解析】解:A、B、C、D、E、F六种原子序数依次增大的短周期元素,A与其余五种元素既不同周期,也不同主族且A的原子序数最小,则A是H元素;B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,B的单质为空气中的主要成分之一,原子序数之和为54,所以B必须为N元素,C元素是O元素,D元素是Mg元素,B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,E的原子序数小于F,则E是Al元素,F是Si元素,(1)A、B形成的化合物是NH3 , 液态时可发生微弱电离,液氨电离方程式为NH3+NH3NH4++NH2﹣ , 电离产生的阴离子的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)某含Si的盐矿石的组成可以看作其氧化物中有
;(2)某含Si的盐矿石的组成可以看作其氧化物中有 ![]() 的Si被Al替换,再由Mg平衡其电荷形成的,二氧化硅中硅的化合价是+4价,铝在化合物中是+3价,镁在化合物中是+2价,二氧化硅的化学式为SiO2 , 有
的Si被Al替换,再由Mg平衡其电荷形成的,二氧化硅中硅的化合价是+4价,铝在化合物中是+3价,镁在化合物中是+2价,二氧化硅的化学式为SiO2 , 有 ![]() 的Si被铝原子取代,设镁原子个数是x,根据化合价的代数和为0得,
的Si被铝原子取代,设镁原子个数是x,根据化合价的代数和为0得, ![]() ×4+
×4+ ![]() ×3+2x=2×2,x=
×3+2x=2×2,x= ![]() ,则该化学式中硅、铝、镁、氧原子个数之比=
,则该化学式中硅、铝、镁、氧原子个数之比= ![]() :
: ![]() :
: ![]() :2=6:2:1:16,所以其化学式为MgO·Al2O3·6SiO2 , 所以答案是:MgO.Al2O3.6SiO2;(3)工业中上,电解Al2O3制备单质Al,阴离子在阳极放电:2O2﹣﹣4e﹣=O2↑;所以答案是:2O2﹣﹣4e﹣=O2↑.
:2=6:2:1:16,所以其化学式为MgO·Al2O3·6SiO2 , 所以答案是:MgO.Al2O3.6SiO2;(3)工业中上,电解Al2O3制备单质Al,阴离子在阳极放电:2O2﹣﹣4e﹣=O2↑;所以答案是:2O2﹣﹣4e﹣=O2↑.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为:________________,此液体具有的性质是_________
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.该液体能发生电泳现象,阴极附近颜色变深
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeC13溶液作为“腐蚀液”,请写出该反应的化学方程式_______________________________。
(3)某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题:
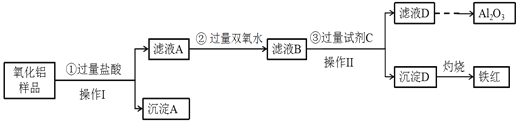
①操作I的名称是_________,该操作用到的玻璃棒的作用 ___________________ 。
②沉淀A的成分是__________(填化学式);验证滤液A中存在Fe3+的具体操作和现象为: _______________________________________________________________。
③用离子方程式说明步骤②中双氧水的作用:
______________________________________________________________。
④滤液D焰色反应呈黄色,试剂C是 ______________(填化学式);
步骤③中铝元素转化的离子方程式 : ___________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,汽车尾气已成为许多大城市空气的主要污染。汽车尾气中含有CO、NO等多种污染物。
⑴汽车燃料中一般不含氮,尾气中所含的NO产生的化学方程式为__ ___ ____。
⑵ 治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装上一个催化转化装置,使NO和CO反应,生成CO2和 N2。反应的化学方程式为 ___ _______。
⑶ 下列措施中,能减少或控制汽车尾气污染有效且可行的是__ ___
① 制定严格的尾气排放标准,并严格执行。
② 开发清洁能源,如氢能汽车、太阳能汽车等。
③ 市民出行带防毒面具。
④ 市民大量移居城市郊区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的使用正确的是( )
A.Cl2通入石灰乳中制漂白粉的离子方程式:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.利用泡沫灭火器灭火时发生的反应:2Al3++CO32﹣+3H2O═2Al(OH)3↓+CO2↑
C.已知离子的还原性:Sn2+>Fe2+ , 则可推测在溶液中能发生如下反应:Sn4++2Fe2+═2Fe3++Sn2+
D.298 K时,已知12g石墨完全燃烧生成CO2(g)放出393.5kJ热量,1mol CO完全燃烧放出283.5kJ热量,则一定有:C(s,石墨)+ ![]() O2(g)═CO(g)△H=﹣110 kJ?mol﹣1
O2(g)═CO(g)△H=﹣110 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是离子反应又是氧化还原反应的是( )
A. 铁片放入CuSO4溶液中 B. 盐酸和氧化镁
C. BaCl2溶液中滴入稀硫酸 D. 氢气还原氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,还原剂与还原产物的物质的量之比为
A. 1:8 B. 8:1 C. 1:5 D. 5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象及相关的离子方程式均正确的是( )
A.Cl2与FeI2溶液反应,当n(Cl2):n(FeI2)=1:1时:2Fe2++2I﹣+2Cl2=2Fe3++I2+4Cl﹣
B.向Ba(NO3)2溶液中通人SO2气体,出现白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+
C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2 MnO4+7 H2O2+6 H+=2Mn2++6O2↑+10 H2O
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO ![]() +H++OH﹣=BaSO4↓+H2O
+H++OH﹣=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com