
【题目】气体打火机使用的燃料要求在室温下为气态,稍一加压,就变成液体,一减压(打开阀门)就汽化并易燃烧。下表中的有机物能较好地满足这些要求的是( )
选项 | A | B | C | D |
分子式 | C2H6 | C3H8 | C4H10 | C5H12 |
熔点/℃ | -183.3 | -181.7 | -138.4 | -127.9 |
沸点/℃ | -88.6 | -42.1 | -0.5 | 36.1 |
A. A B. B C. C D. D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室及能源问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:
CH3OH(g)+![]() O2(g) = CO2(g)+2H2O(1) △H1=akJmol-1
O2(g) = CO2(g)+2H2O(1) △H1=akJmol-1
H2(g)+![]() O2(g) = H2O(1) △H2=bkJmol-1
O2(g) = H2O(1) △H2=bkJmol-1
H2O(g) = H2O(l) △H3=ckJmol-1
则 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=__________kJmol-1
CH3OH(g)+H2O(g) △H=__________kJmol-1
(2)CO2催化加氢也能合成低碳烯烃: 2CO2(g)+6H2(g)![]() C2H4(g)+4 H2O (g),不同温度下平衡时的四种气态物质的物质的量如图1所示,曲线b表示的物质为_______________ (写化学式)。
C2H4(g)+4 H2O (g),不同温度下平衡时的四种气态物质的物质的量如图1所示,曲线b表示的物质为_______________ (写化学式)。

(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应 A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应B:CO2(g)+ H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。

① 由图2可知温度升高CO的产率上升,其主要原因可能是__________________。
② 由图2可知获取CH3OH最适宜的温度是________________,下列措施有利于提高CO2转化为CH3OH的平衡转化率的措施有__________________。
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
(4)在催化剂表面通过施加电压可将溶解在水中的二氧化碳直接转化为乙醇,则生成乙醇的电极反应式为______________________________________________________。
(5)由CO2制取C的太阳能工艺如图3所示。“热分解系统”发生的反应为:2Fe3O4![]() 6FeO+O2↑,每分解1mol Fe3O4转移电子的物质的量为_____________;“重整系统”发生反应的化学方程式为_____________________________________________。
6FeO+O2↑,每分解1mol Fe3O4转移电子的物质的量为_____________;“重整系统”发生反应的化学方程式为_____________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用洗涤剂是污水中磷元素的重要来源(洗涤剂中常含有三聚磷酸钠),必须采取有效措施控制磷元素大量进入水体,其原因是
A. 使水体酸度大大增加,腐蚀桥梁、闸门等设备
B. 磷酸根进入水体,形成多种不溶性的磷酸盐,再吸附杂质,使河床抬高造成水患
C. 浮游生物得到养分,大量繁殖,死亡后腐败耗尽水中氧,使水质恶化
D. 磷酸盐有毒、致癌,不能进入水体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
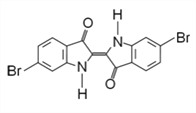
A. 属于烃的衍生物
B. 分子式为Cl6H8O2N2Br2
C. lmol该有机物与H2加成最多消耗9molH2
D. 该有机物溴元素检验可将有机物与碱液共热后,直接加入硝酸银溶液,观察是否有浅黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
某药厂在合成一种用于抑制血小板聚集的药物时使用到中间体有机物M,下图为有机物M(![]() )的合成路线:
)的合成路线:

已知:①B是石油裂解的主要产物,其产量用于衡量化工发展的水平。
②R—CHO+Rˊ—CH2COOR ![]()

回答下列问题:
(1)E的化学名称是___________;C的官能团名称为____________。
(2)反应条件①为_____________。
(3)C7H7C1→A的化学方程式为____________________。
A+D→E的反应类型为________________。
(4)F分子的结构简式为________,其最多有______个原子共平面。
(5)能同时满足下列条件的M的同分异构体共有______种。(不含立体异构)
①属于苯的对位二取代衍生物,且与M具有相同官能团;② 与苯环相连;③能够发生水解反应④能够发生银镜反应。
与苯环相连;③能够发生水解反应④能够发生银镜反应。
(6)参照上述合成路线,请填写方框中的空白,以完成制备聚丙烯酸甲酯的合成路线。______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,向20. 00 mL 0.1000 mol·L-1的醋酸溶液中逐滴加入0.1000mol·L-1的NaOH溶液,测得混合溶液的温度变化如图。下列相关说法正确的是( )

A. 若a点溶液呈酸性,此时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-)
B. 从a到b:![]() 逐渐增大
逐渐增大
C. 水的电离程度:b点<c点
D. 溶液的PH值:a点<c点<b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同一周期。m、n、s是由这些元素组成的二元化合物,p、q分别是W、Z两元素对应的单质,0.001 mol·L-1s溶液的pH为3, t是混合溶液,且该溶液具有漂白性。上述物质的转化关系如图所示。下列说法正确的是

A. 元素Y分别与W、X、Z形成的化合物中一定含有离子键
B. 离子半径:X<Y<Z
C. 由元素W、X组成的化合物中一定只含极性键
D. s为强酸,r为弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,使海水分解得到氢气的新技术:
2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,实现了从________能转变为________能。生成的氢气用于燃料电池时,实现________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于_______反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是________,发生的电极反应为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com