
| A. | 35.5 | B. | 71g | C. | 35.5g/mol | D. | 71g/mol |
科目:高中化学 来源: 题型:解答题
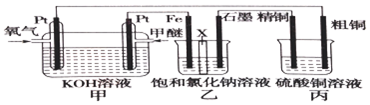
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后容器内的气体只有CO | |
| B. | 反应后生成的CO与反应前的CO2的物质的量之比为1:1 | |
| C. | 反应后生成的CO与反应前的CO2的分子数目之比为3:2 | |
| D. | 反应后容器内的气体与反应前的CO2所含的氧原子数目之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
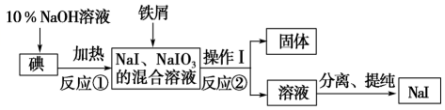
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用NaOH已经潮解 | B. | 定容时俯视 | ||
| C. | 有少量NaOH溶液残留在烧杯里 | D. | 称量时误用“左码右物” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.01×1023个双氢青蒿素的质量为142 g•mol-1 | |
| B. | 双氢青蒿素中的C、H、O三种元素的质量比45:6:20 | |
| C. | 7.1 g双氢青蒿素中含有的氢原子总数为1.2NA | |
| D. | 含有NA个碳原子的双氢青蒿素的物质的量为1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com