
下列装置或操作能达到实验目的的是( )

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A、16O、18O互为同位素
B、金刚石和石墨互为同素异形体
C、分子式符合通式CnH2n+2 且 n 值不同的两种烃互为同系物
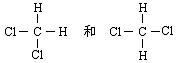
D、 互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A、两种烃相对分子质量相等,但结构不同,性质也不同,一定是同分异构体
B、有机物与无机物之间也可出现同分异构体
C、两种化合物若互为同分异构体,则它们一定不互为同系物
D、两种烃所含碳元素的质量分数相等,但不一定互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列技术手段或仪器在化学研究中的应用的说法中不正确的是( )
A.用电子天平可直接称出某个分子或原子的质量
B.用pH计测定溶液的pH
C.用移液管量取25.00 mL溶液
D.用量热计测定某些化学反应中的热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列相关实验不能达到预期目的的是( )
| 相关实验 | 预期目的 | |
| A | 相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓度的盐酸反应 | 探究接触面积对化学反应速率的影响 |
| B | 把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜并加热 | 探究蔗糖水解产物具有还原性 |
| D | 两支试管中装有等体积、等浓度的H2O2溶液,向其中一支试管中加入FeCl3溶液 | 探究FeCl3溶液对H2O2分解速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。

(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
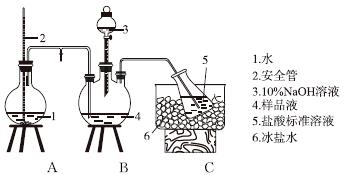
氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是__________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是____________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;X的制备过程中温度不能过高的原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com