
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00g·cm-3,则铜晶胞的体积是
cm3、晶胞的质量是 g,阿伏加德罗常数为 (列式计算,己知Ar(Cu)=63.6);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 ;

(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方应程式为 。
(1)1s22s22p63s23p63d104s1;(2)4.70×10-23;4.23×10-22;NA=63.6g.mol-1/(0.25×4.23×10-22g)=6.01×10-23;(3)sp3;K2CuCl3;(4)过氧化氢为氧化剂,氨与Cu形成配离子,两者相互促进使反应进行;Cu+H2O2+4NH3 = Cu(NH3)42+ +2OH-。
【解析】:(1)根据铜元素在周期表中的位置:第四周期第IB族,其核外电子排布式为:1s22s22p63s23p63d104s1;(2)根据晶胞的边长,其体积为a3,即4.70×10-23 cm3;晶胞的质量=体积×密度,故其质量为4.23×10-22g;在一个体心晶胞含4个铜原子,故铜的摩尔质量=1/4×晶胞质量×NA,可知NA=63.6g.mol-1/(0.25×4.23× 10-22g)=6.01×10-23;(3)a位置上Cl原子的杂化轨道类型为:sp3;一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,其化学式为:K2CuCl3;(4)题中给出了两物质和铜单独不反应,而同时混合能反应,说明两者能互相促进,其中过氧化氢为氧化剂,氨与Cu形成配离子,两者相互促进使反应进行;方程式可表示为:Cu+H2O2+4NH3 = Cu(NH3)42+ +2OH-。
【考点定位】此题以铜元素及其化合物为载体,综合考查了物质结构与性质模块的主干知识。
[选修2——化学与技术]


科目:高中化学 来源:2013-2014上海市静安区第二学期高二学业水平测试化学试卷(解析版) 题型:选择题
以下有关物质用途的叙述错误的是
A.明矾:净水剂
B.四氯化碳:灭火剂
C.四氧化三铁:红色颜料
D.小苏打:治胃酸过多
查看答案和解析>>
科目:高中化学 来源:2013-20147山东省乳山市下学期期中考试高二化学试卷(解析版) 题型:选择题
在一定条件下,下列药物的主要成分都能发生①取代②加成③水解④中和四种反应的是
①维生素 ②阿司匹林
②阿司匹林 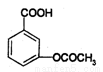
③芬必得 ④扑热息痛
④扑热息痛 
A. ①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(重庆卷解析版) 题型:填空题
(15分)(2012?重庆)氯离子插层镁铝水滑石[Mg2Al(OH)6Cl?xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气.现用如图装置进行实验确定其化学式(固定装置略去).
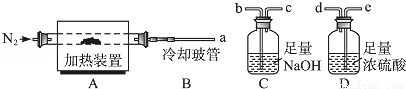
(1)Mg2Al(OH)6Cl?xH2O热分解的化学方程式为 .
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为 (按气流方向,用接口字母表示),其中C的作用是 .装置连接后,首先要进行的操作的名称是 .
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,再持续通入N2的作用是 、 等.
(4)完全分解后测得C增重3.65g、D增重9.90g,则x= .若取消冷却玻管B后进行实验,测定的x值将 (填“偏高”或“偏低”).
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1﹣2x(CO3)y?zH2O],该生成物能发生类似的热分解反应.现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z,除测定D的增重外,至少还需测定 .
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(重庆卷解析版) 题型:选择题
(6分)(2012?重庆)对实验:①中和滴定、②中和热的测定、③实验室制备乙烯、④乙酸乙酯的制取,叙述正确的是( )
A.①④必须加热 B.②③必须隔热 C.①②必须用指示剂 D.③④必须用催化剂
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:填空题
(9分)已知A(g)+B(g) 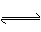 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)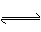 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:选择题
两种盐的固体混合物:①加热时有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸。满足上述条件的混合物是
A.BaCl2和(NH4)2SO4 B.AgNO3和NH4Cl
C.FeCl3和NaHCO3 D.KCl和Na2CO3
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(浙江卷解析版) 题型:选择题
下列说法正确的是
A.在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全。
B.在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在。
C.在“硫酸亚铁铵的制备”实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热。
D.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(大纲全国解析版) 题型:填空题
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按图所示步骤进行操作.
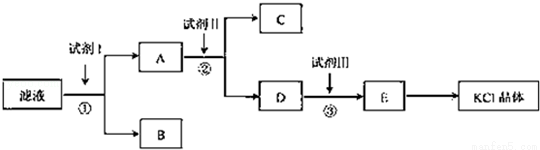
回答下列问题:
(1)起始滤液的pH 7(填“大于”、“小于”或“等于”),其原因是 .
(2)试剂I的化学式为 ,①中发生反应的离子方程式为 .
(3)试剂Ⅱ的化学式为 ,②中加入试剂Ⅱ的目的是 ;
(4)试剂Ⅲ的名称是 ,③中发生反应的离子方程式为 ;
(5)某同学称取提纯的产品0.7759g,溶解后定定容在100mL容量瓶中,每次取25.00mL溶液,用0.1000mol?L﹣1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62mL,该产品的纯度为 .(列式并计算结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com