
最近中国科学院上海高等研究院在合成气直接制烯烃研究获重大突破。已知:
反应①:C(s)+1/2O2(g)=CO(g) △H1
反应②:C(s)+H2O(g)=CO(g)+H2(g) △H2
反应③:CO(g)+2H2(g)=CH3OH(g) △H3=-90.1kJ·mol-1
反应④:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=-134.0kJ·mol-1
反应⑤:3CH3OH(g)=CH3CH=CH2(g)+3H2O(g) △H5=-31.0kJ·mol-1
下列说法正确的是
A.△H1-△H2<0
B.反应②为放热反应
C.3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g) △H=-103.0kJ·mol-1
D.3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g) △H=-301.3kJ·mol-1
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:2017届北京市高三上学期期中化学试卷(解析版) 题型:填空题
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
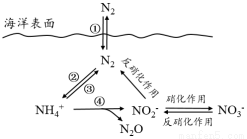
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是 (填字母序号)。
a. 海洋中的氮循环起始于氮的氧化
b. 海洋中存在游离态的氮
c. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
d. 海洋中的反硝化作用一定有氧气的参与
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将离子方程式补充完整:
 NH4++5O2
NH4++5O2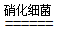 2NO2-+
2NO2-+ H++
H++ +
+
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg | 处理24 h | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是 ,在最佳反应温度时,48 h内去除氨氮反应的平均速率是 mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。如图是间接氧化工业废水中氨氮(NH4+)的示意图。
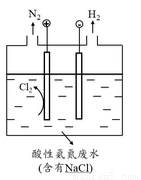
结合电极反应式简述间接氧化法去除氨氮的原理: 。
若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将 (填“增大”、“不变”或“减小”),请简述理由: 。
查看答案和解析>>
科目:高中化学 来源:2017届湖南湖南省长沙市高三月考试卷三化学试卷(解析版) 题型:选择题
水热法制备Fe2O3纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,关于该反应下列说法正确的是
A.H2O和S4O62-都是还原产物
B.1molFe2+参加反应时,转移2mol电子
C.Fe2+、S2O32-都是还原剂
D.x=2
查看答案和解析>>
科目:高中化学 来源:2017届河北辛集中学高三上理综测试三化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3 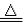 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75 NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75 NA
查看答案和解析>>
科目:高中化学 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:填空题
从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染。
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为 。
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2-HCl- NaCl混合溶液浸取回收。
①用FeCl3溶液浸取铜时发生反应的离子方程式为 ;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是 。
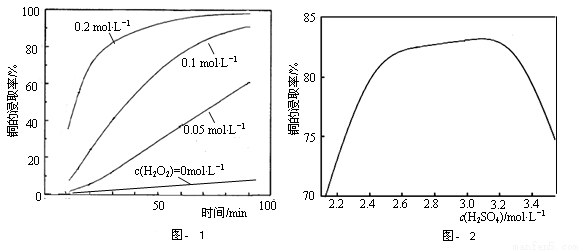
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3mol·L-1盐酸、0.5mol·L-1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图-1所示。当c(H2O2)= 0 mol·L-1时,也有少量的铜被浸出,其原因是 。
③用H2O2-HCl- NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ)Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ)Cu2++Cu 2Cu+
2Cu+
(Ⅲ)Cu++nCl- CuCln(n-1)-
CuCln(n-1)-
(Ⅳ)2CuCln(n-1)-+2H++H2O2=2Cu2++2H2O+2nCl-
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是 (填序号)。
a.Na+ b.Cu2+ c.Cl- d.OH-
(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl-H2O2混合溶液浸取。
①Cu2S被HCl-H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为 。
②若由H2SO4代替HCl-H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图-2所示。当H2SO4浓度大于3.1mol·L-1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:选择题
2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示。下列说法正确的是
A.化学能转变为电能
B.阴极的电极反应为:CO2+4e-=C↓+2O2-
C.阳极的电极反应为:2CO32--4e-=2CO2↑+O2↑
D.阴极上每通过4mole-,阴极区有1molCO2参与反应
查看答案和解析>>
科目:高中化学 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:选择题
纤维素等生物碳源材料可以高产率制备石墨烯(如图),下列说法正确的是
A.石墨烯导电属于化学变化
B.石墨烯与金刚石结构相同
C.纤维素与淀粉互为同分异构体
D.纤维素属于天然高分子化合物
查看答案和解析>>
科目:高中化学 来源:2017届江苏省徐州、宿迁、连云港、淮安四市高三11月模拟化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.镀铜铁制品镀层破损后,铁制品比破损前更容易生锈
B.标准状况下,22.4 L Cl2与足量NaOH溶液反应,转移电子数为2mol
C.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源:2017届云南曲靖市高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.胶体与其他分散系的本质区别是粒子直径的大小在1-100nm之间
B.可以利于丁达尔效应区分胶体和溶液
C.胶体均能发生布朗运动和电泳现象
D.胶体在一定条件下能稳定存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com