
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方
程式:_____________________________________________________。
(2)写出“联合制碱法”有关反应的化学方程式:_______________________
____________________________________________________________。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源
有何不同?________________________________________________。
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计算原子利用率的表达式:原子利用率(%)=_________________。
解析 氨碱法的原料:氯化钠、碳酸钙(或二氧化碳)及氨。
工艺流程:CaCO3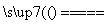 CaO+CO2↑
CaO+CO2↑
CO2+NH3+H2O===NH4HCO3,
NaCl+NH4HCO3===NaHCO3↓+NH4Cl,
2NaHCO3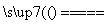 Na2CO3+H2O↑+CO2↑,
Na2CO3+H2O↑+CO2↑,
CaO+H2O===Ca(OH)2,
产生CaCl2的反应:Ca(OH)2+2NH4Cl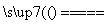 CaCl2+2NH3↑+2H2O,该反应
CaCl2+2NH3↑+2H2O,该反应
的CaCl2中的Cl-来源于NaCl,Ca2+来源于CaCO3,产生无用的CaCl2,降低
了NaCl的利用率。
联合制碱法:NH3和CO2来源于合成氨厂
工艺流程:NH3+CO2+H2O===NH4HCO3,
NaCl+NH4HCO3===NaHCO3↓+NH4Cl,
2NaHCO3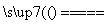 Na2CO3+H2O↑+CO2↑。
Na2CO3+H2O↑+CO2↑。



依据总反应:2NaCl+CO2+H2O+2NH3===Na2CO3+2NH4Cl
可得:原子利用率= ×100%=49.77%。
×100%=49.77%。
答案 (1)2NH4Cl+Ca(OH)2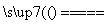 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)NH3+CO2+H2O===NH4HCO3
NaCl+NH4HCO3===NaHCO3↓+NH4Cl
2NaHCO3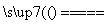 Na2CO3+H2O↑+CO2↑
Na2CO3+H2O↑+CO2↑
(3)“联合制碱法”中的CO2来源于合成氨厂,“氨碱法”中的CO2来源于煅
烧石灰石
(4) ×100%=49.77%
×100%=49.77%


科目:高中化学 来源: 题型:
能证明苯酚具有弱酸性的实验是( )
A.加入浓溴水生成白色沉淀
B.苯酚钠溶液中通入CO2后,溶液由澄清变浑浊
C.浑浊的苯酚加热后变澄清
D.苯酚的水溶液中加NaOH溶液,生成苯酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,可逆反应HAH++A-的电离常数为Ka,下列说法不正确的是( )
A. Ka越大,表示该弱酸越易电离
B.此可逆反应的Ka=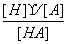
C. Ka随反应物浓度的改变而改变
D. Ka随体系温度的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A.甲醇 B.天然气
C.液化石油气 D.氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4;
2NaCl+H2SO4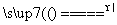 Na2SO4+2HCl↑
Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S;
Na2SO4+4C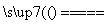 Na2S+4CO↑
Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3;
Na2S+CaCO3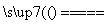 Na2CO3+CaS
Na2CO3+CaS
(2)下列说法正确的是 ( )。
A.②③两步都是氧化还原反应
B.只有第②步是氧化还原反应
C.该方法对生产设备基本没有腐蚀
D.该方法对环境污染较小
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示的是侯氏制碱法工艺流程示意图。
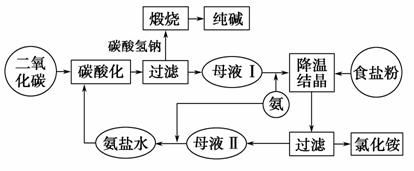
请回答:
(1)母液Ⅱ中所溶解的主要物质是________(写物质的化学式)。母液Ⅱ中含有
低浓度的Na2CO3,主要原因是______________________________________
____________________________________________________________。
(2)向母液Ⅱ中通入气体时要先通氨气后通二氧化碳气体,主要原因是
__________________________________________________________________
___________________________________________________________。
(3)母液Ⅰ和母液Ⅱ中都通入NH3。①NH3的主要来源是__________;②母液
Ⅰ中通入NH3的主要目的是____________;③母液Ⅱ中通入NH3的主要目的
是__________________。
(4)工艺流程的“煅烧→纯碱”处,可设计____________的循环。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇的沸点比含相同碳原子的烷烃的沸点高的主要原因是( )
A.乙醇的分子量比含相同碳原子的烷烃的分子量大
B.乙醇分子之间易形成氢键
C.碳原子与氢原子的结合程度没碳原子与氧原子的结合程度大
D.乙醇是液体,而乙烷是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列条件下,能大量共存的微粒组是
A.c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32-
B. 右表提供的数据下:HClO 、HCO3-、ClO-、CO32-
C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I-
D.中性的溶液中:CO32-、Na+、SO42-、AlO2-
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ki =1.7×10-5 |
| HClO | Ki =3.0×10-8 |
| H2CO3 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中一定能判断某化学平衡发生移动的是( )
A.混合物中各组分的浓度改变
B.正、逆反应速率改变
C.混合物中各组分的含量改变
D.混合体系的压强发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com