
工业制硫酸生产流程如下图:

已知:在450℃,常压下,2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答:
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率可采取的措施为
A.净化气体  B.控制温度在400~500℃
B.控制温度在400~500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”、“>”或“=”)196kJ。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下,现有100L原料气参加反应,达到平衡时,气体的总体积变 为97.2L,则SO2的转化率为
为97.2L,则SO2的转化率为
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断不正确的是
A.与水反应的剧烈程度:甲>乙>丁
B.气态氢化物的沸点:戊<己<庚
C.丙和庚的核外电子数相差15
D.乙单质在空气中燃烧生成含共价键的离子化合物
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在溶液中一定能大量共存的是
A.pH=12的溶液:K+、Na+、CH3COO—、CO32—
B.与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3—、NO3—
C.由水电离产生的c(H+)=10-13mol/L的溶液:NH4+、Ca2+、SO32—、Cl—
D.0.1 mol/L的NaNO3溶液:H+、Fe2+、Cl—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作完全正确的是
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 取出 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B.1∶3 C.1∶4 D.2∶3
1∶1 B.1∶3 C.1∶4 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
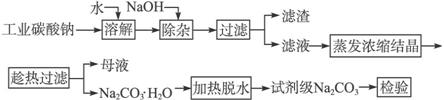
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
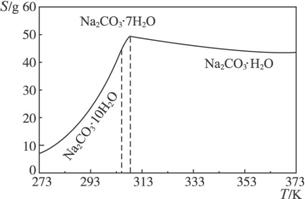
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为________________。
(2)“趁热过滤”的原因是________________________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是_______________________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_____________________________。
(5)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(s)+O2(g) 2SO3(g).
2SO3(g).
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:

①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
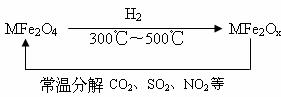
请写出MFe2Ox分解SO2的化学方程式________________(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn。回答下列问题:
(1)X原子的电子排布式为___________。
(2)电负性:X ______Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的
化工原料。有关Z2H4分子的说法正确的是______(填字母)。
A.Z的原子与氢原子形成的化学键可以旋转 B.不含非极性键
C.分子中含有氢键 D.含有4个σ键和1个π键
(4)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是_____ (填字母)。
A.离子键 B.极性键 C.配位键 D.金属键
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com