
| A. | 铁不剩余,Cu剩余 | B. | 铜不剩余、铁剩余 | C. | 铁、铜均剩余 | D. | 铁、铜均不剩余 |
分析 A、铜剩余,铜能够和三价铁离子反应,溶液中不会存在Fe3+;
B、铁剩余,还原性铁大于铜;
C、铁、铜均剩余,溶液中不会存在Fe3+;
D、铁、铜恰好与FeCl3溶液反应.
解答 解:充分反应后加入KSCN不现红色,证明溶液中没有Fe3+;
A、还原性铁大于铜,铜有剩余,溶液中不会存在Fe3+,故A不选;
B、还原性铁大于铜,所以不可能铁剩余,铜不剩余,故B选;
C、铁过量,会出现铁、铜均剩余,溶液中不存在 Fe3+,故C不选;
D、铁、铜恰好与FeCl3溶液反应,溶液中也无铁离子,故D不选;
故选B.
点评 本题考查了氧化还原反应、还原性强弱的判断、三价铁离子的检验方法,综合性强,但比较容易.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,15g甲基(-CH3)所含的中子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
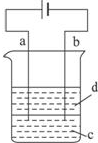 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、NO3-、K+ | B. | Al3+、Na+、Cl-、SO42- | ||
| C. | Na+、Ba2+、NO3-、Cl- | D. | K+、Na+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
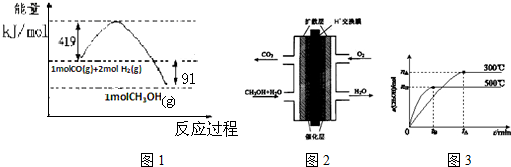
| 化学键 | H-H | H-O | O=O |
| 键能KJ/mol | 436 | x | 496 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤ | B. | ①③⑤ | C. | ③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com