
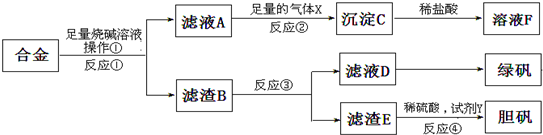


科目:高中化学 来源: 题型:
| A、Na2O2的水解产物是NaOH和H2O2 |
| B、PCl3的水解产物是PH3和HClO |
| C、Mg3N2的水解产物是Mg(OH)2和NH3 |
| D、SiCl4的水解产物是H4SiO4与HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| +2 |
| Xe |
| -2 |
| F |
| +1 |
| X |
| -1 |
| F |

查看答案和解析>>
科目:高中化学 来源: 题型:
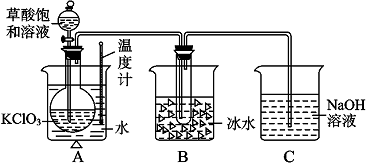
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入加入足量0.1mol?L-1 CH3COOH. | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② … | 若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:
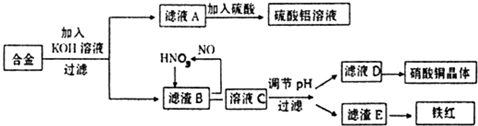
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Ag+ Mg2+ Ba2+ |
| 阴离子 | NO3- CO32- SiO32- SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中 加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com