
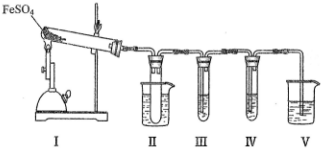
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入BaCl2溶液 | 产生白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入酸性 KMnO4 溶液 | 若溶液紫色褪去, 证明气体产物中含有SO2, 若溶液紫色无明显变化, 证明气体产物中不含SO2 |
分析 已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.探究在酒精喷灯加热条件下FeSO4分解的气体产物,
(1)装置Ⅱ的试管中不装任何试剂,根据安全瓶的作用是可以防止倒吸;
(2)当温度高于44.8°C时SO3为气体状态;
(3)根据FeSO4分解的气体产物可能为SO3,也可能是SO3和SO2的混合物,SO3遇到钡离子生成白色沉淀,SO2能使高锰酸钾或溴水褪色;
(4)根据SO2尾气处理用烧碱溶液.
解答 解:(1)Ⅰ中产生的气体极易和溶液反应时,会产生倒吸,所以装置II的试管能防止溶液倒吸入装置Ⅰ中(或安全瓶);
故答案为:防止溶液倒吸入装置Ⅰ中(或安全瓶);
(2)SO3的沸点是44.8°C,当温度高于44.8°C时SO3为气体状态,把试管浸泡在50℃的热水浴中能防止SO3液化或凝固,
故答案为:防止SO3液化或凝固;
(3)FeSO4分解的气体产物可能为SO3,也可能为SO3和SO2的混合物,SO3遇到钡离子生成白色沉淀,SO2能使高锰酸钾或溴水褪色;
故答案为:
| BaCl2溶液 | |
| 酸性 KMnO4 溶液 | 若溶液紫色褪去, 证明气体产物中含有SO2, 若溶液紫色无明显变化, 证明气体产物中不含SO2 |
点评 本题主要考查了二氧化硫和二氧化硫的检验,掌握两者性质的差异是解题的关键,题目综合性较强,难度中等.


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 干燥的NaCl晶体不能导电,但NaCl是电解质 | |
| B. | 食盐水能导电,所以食盐水是电解质 | |
| C. | 三氧化硫溶于水能导电,所以三氧化硫是电解质 | |
| D. | 一种物质如果不是电解质,那么它一定是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | 常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化 | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
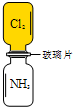 室温下,抽取图两瓶体积相等的氯气和氨气之间的玻璃片后,立即观察到有浓郁白烟,同时一瓶中黄绿色迅速褪去.充分反应后体系中的还原产物是( )
室温下,抽取图两瓶体积相等的氯气和氨气之间的玻璃片后,立即观察到有浓郁白烟,同时一瓶中黄绿色迅速褪去.充分反应后体系中的还原产物是( )| A. | NH4Cl | B. | HCl | C. | N2 | D. | H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
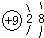 ⑤$\stackrel{+2}{M}g$( )
⑤$\stackrel{+2}{M}g$( )| A. | ①② | B. | ②④ | C. | ③④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物对应的水化物的碱性:Y>R>X | |
| D. | 相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的热化学方程式M(g)+3N(g)?2R(g)△H>0 | |
| B. | 达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 | |
| C. | 达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小 | |
| D. | 达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com