
| A. | 为防止催化剂中毒,炉气在进入接触室之前需要净化 | |
| B. | 为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ | |
| C. | 为防止污染大气,从吸收塔出来的尾气常用稀氨水吸收 | |
| D. | 为提高SO3的吸收效率,用稀硫酸代替水吸收SO3. |
分析 A.生产分三步,二氧化硫的制取和净化、二氧化硫转化为三氧化硫、三氧化硫的吸收,分别在沸腾炉、接触室、吸收塔中进行;其中从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒;
B.二氧化硫与氧气反应生成三氧化硫为放热反应,高温的目的是考虑催化剂的活性;
C.尾气中的SO2通常用足量氨水吸收;
D.工业上在吸收塔内用浓硫酸吸收,防止形成酸雾阻止充分吸收.
解答 解:A.制备硫酸过程中,从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒,故A正确;
B.二氧化硫与氧气反应生成三氧化硫为放热反应,所以低温有利于提高二氧化硫转化率,接触室内反应温度选定在400℃~500℃是考虑催化剂活性,故B错误;
C.为防止污染大气,从吸收塔出来的尾气常用氨水吸收,故C正确;
D.工业上在吸收塔内用浓硫酸吸收,防止形成酸雾阻止充分吸收;稀硫酸吸收容易形成酸雾,故D错误.
故选:AC.
点评 本题考查了硫酸的工业制备方法,熟悉硫酸制备的工艺流程及二氧化硫与氧气合成三氧化硫特点是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
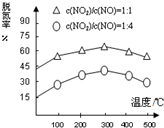

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应发生的过程中,只放出能量 | |
| B. | 化学反应中的能量通常表现为热量的变化 | |
| C. | 锌与盐酸反应是吸热的过程 | |
| D. | 反应物的总能量高于生成物的总能量为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙、丁 | B. | 乙、甲、丙、丁 | C. | 乙、甲、丁、丙 | D. | 丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| O═O | H-H | H-O(g) | |
| 1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
| A. | 920 | B. | 557 | C. | 463 | D. | 188 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
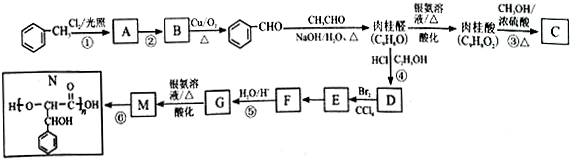
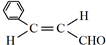 .
. .
.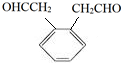 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com