
【题目】1.52g铜镁合金完全溶解于50mL浓度14.0mol/L的硝酸中,得到NO2和N2O4的混合气体1120ml(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时得到2.54g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.NO2和N2O4的混合气体中,NO2的体积分数是80%
C.得到2.54g沉淀时加入NaOH溶液的体积是600mL
D.溶解合金消耗HNO3的量是0.12mol
【答案】C
【解析】
根据氧化还原反应中得失电子守恒、元素守恒进行分析计算。
A. 金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中OH-的质量为:2.54g1.52g=1.02g,![]() ,根据电荷守恒可知,金属提供的电子物质的量等于OH-的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.06、64x+24y=1.52,解得:x=0.02、y=0.01,则该合金中n(Cu):n(Mg)=2:1,故A正确;
,根据电荷守恒可知,金属提供的电子物质的量等于OH-的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.06、64x+24y=1.52,解得:x=0.02、y=0.01,则该合金中n(Cu):n(Mg)=2:1,故A正确;
B. 标况下1.12L气体的物质的量为0.05mol,设混合气体中二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05a)mol,根据电子转移守恒可知:a×1+(0.05a)×2×1=0.06,解得a=0.04,则混合气体中含有二氧化氮0.04mol、四氧化二氮0.01mol,NO2和N2O4的混合气体中,NO2的体积分数为:![]() ,故B正确;
,故B正确;
C. 50mL该硝酸中含有硝酸的物质的量为:14mol/L×0.05L=0.7mol,反应后的溶质为硝酸钠,根据N元素守恒,硝酸钠的物质的量为:n(NaNO3)=n(HNO3)-n(NO2)-2n(N2O4)=0.7mol0.04mol0.01×2=0.64mol,故需要氢氧化钠溶液的体积为![]() ,故C错误;
,故C错误;
D. Cu、Mg的物质的量分别为0.02mol、0.01mol,则生成Cu(NO3)2、Mg(NO3)2各0.02ml、0.01mol,NO2和N2O4的物质的量分别为0.04mol、0.01mol,则根据N元素守恒可知,消耗硝酸的物质的量为0.02×2+0.01×2+0.04+0.01×2=0.12mol,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分MnO2,还含有Fe2O3、Al2O3、SiO2等,用软锰矿浆吸收工业废气中的二氧化硫,制备高锰酸钾的流程如图所示:
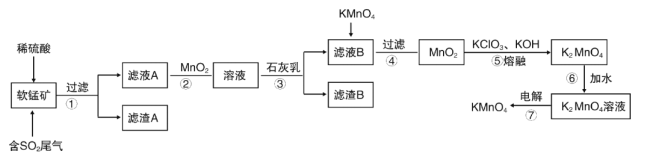
已知:滤液A中的金属阳离子主要是Mn2+还含有少量的Fe2+、Al3+等,几种离子开始沉淀和完全沉淀时的pH如右表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出软锰矿通入二氧化硫发生的主要反应的化学方程式__。
(2)滤渣A的成分是__,其中的化学键类型是___。
(3)步骤②中加入MnO2的作用__。
(4)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此观点___?简述理由___。
(5)滤液B中加入KMnO4时发生反应的离子方程式是__。
(6)第⑦步用镍片(镍不参与反应)和铁板作电极,电解K2MnO4溶液可制备KMnO4。有关说法正确的是__(填字母)

A.a与电源的负极相连
B.离子交换膜为阳离子交换膜
C.阳极的电极反应为MnO42--e-=MnO4-
D.阴极的电解产物为KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。已知某一种肉桂酸甲酯的分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。
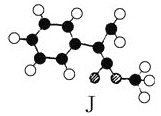
试回答下列问题。
(1)肉桂酸甲酯的结构简式为__________________。
(2)在苯环上的一氯代物有________种。
(3)写出该肉桂酸甲酯在氢氧化钠溶液中水解的化学方程式:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种
B.常压下,正戊烷、异戊烷、新戊烷的沸点依次降低
C.肌醇 与葡萄糖
与葡萄糖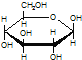 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
D.1.0 mol的有机物(结构如图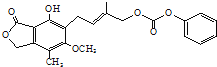 )最多能与含4.0molNaOH的水溶液完全反应
)最多能与含4.0molNaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物FeCl2、FeCl3、CuCl2、Cu;
(1)将上述反应设计成的原电池如图甲所示请回答下列问题:

①图中X溶液是__;
②Cu电极上发生的电极反应式为__;
③原电池工作时,盐桥中的__填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成电解池如图乙所示乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是电源的__极;
②图丙中的②线是__的变化;
③当电子转移为0.2mol时向乙烧杯中加入__L5mol/LNaOH溶液才能使所有的金属阳离子沉淀完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳樟醇和橙花叔醇是决定茶叶花甜香的关键物质。芳樟醇和橙花叔醇的结构如图所示,下列有关叙述正确的是

A. 橙花叔醇的分子式为C15H28O
B. 芳樟醇和橙花叔醇互为同分异构体
C. 芳樟醇和橙花叔醇与H2完全加成后的产物互为同系物
D. 二者均能发生取代反应、加成反应、还原反应,但不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
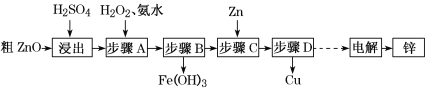
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在![]() 的
的![]() ,溶液中有关粒子浓度由大到小的顺序为
,溶液中有关粒子浓度由大到小的顺序为![]() 。
。
(1)该溶液中![]() ________
________![]() (填“>”“=”或“<”),简述理由:_______________________________________________________________
(填“>”“=”或“<”),简述理由:_______________________________________________________________
(2)现向![]() 溶液中,逐滴加入少量含有酚酞的
溶液中,逐滴加入少量含有酚酞的![]() 溶液,可观察到的现象是__________________________________________________________;写出该反应的离子方程式:____________________________________。
溶液,可观察到的现象是__________________________________________________________;写出该反应的离子方程式:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com