
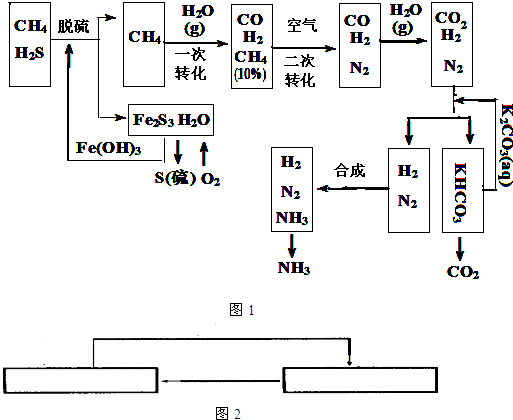
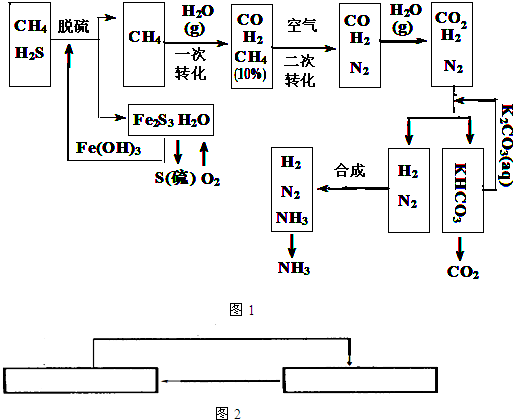
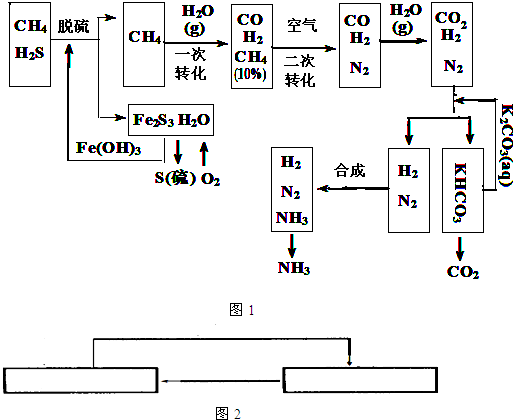
合成氨的流程示意图如下:
回答下列问题:
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为______,设备A的名称是______;
(2)设备B中m和n是两个通水口,入水口是______(填“m”或“n”).不宜从相反方向通水的原因是______;
(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是______,______;
(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28109 | 38109 | 48109 |
①依据上表信息,你认为采用______为原料最好;
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:______;
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ/mol;
2CO2(g)+O2(g)═CO2(g)△H=-566kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式______;
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:______.
 2NH3,设备A的作用是能将氮气和氢气反应,所以设备A的名称是合成塔,
2NH3,设备A的作用是能将氮气和氢气反应,所以设备A的名称是合成塔, 2NH3;合成塔;
2NH3;合成塔; CO+3H2,
CO+3H2, CO+3H2;
CO+3H2; C-
C- B可得C(S)+H2O(g)
B可得C(S)+H2O(g) CO(g)+H2(g) △H=+131KJ/mol,
CO(g)+H2(g) △H=+131KJ/mol, CO(g)+H2(g) △H=+131KJ/mol;
CO(g)+H2(g) △H=+131KJ/mol; 2NH3,该反应为可逆反应,从化学平衡移动的角度考虑,减少生成物的浓度,化学平衡向正反应方向移动,
2NH3,该反应为可逆反应,从化学平衡移动的角度考虑,减少生成物的浓度,化学平衡向正反应方向移动,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:梅州模拟 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2009年广东省梅州市高考化学模拟试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com