
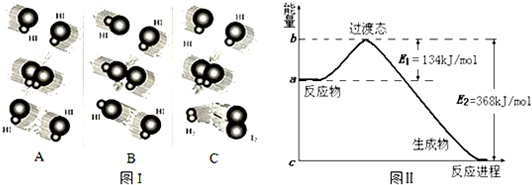
分析 (1)根据活化分子发生有效碰撞时发生化学反应进行判断;
(2)反应物总能量大于生成物总能量,应为放热反应,反应热为134kJ/mol-368kJ/mol=-234kJ/mol;
(3)加入催化剂,降低反应物的活化能,反应速率加快.
解答 解:(1)只有发生化学反应的碰撞才是有效碰撞,分析三个图,可知只有C有新物质生成,则C为有效碰撞,
故答案为:C;
(2)反应热为134kJ/mol-368kJ/mol=-234kJ/mol,则反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol;
(3)加入催化剂,降低反应物的活化能,反应速率加快,图象应为 ,
,
故答案为:减小;减小; .
.
点评 本题考查较为综合,题目难度中等,本题注意有效碰撞的概念的理解,为易错点,学习中要准确把握,另外注意反应热的计算.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池负极发生氧化反应 | |
| B. | 一般相对活泼的金属材料做电池的负极 | |
| C. | 电子流向是从负极流向正极(外电路) | |
| D. | 阳离子移向负极(内电路) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
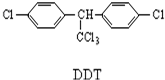
| A. | 它属于芳香烃 | B. | 分子式为C14H8Cl5 | ||
| C. | 1mol该物质能与6mol H2加成 | D. | 分子中最多可能有28个原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数是次外层电子数的2倍 |
| X | L层有三个未成对电子 |
| Y | L层p电子数比s电子数多两个 |
| Z | 元素的最高正价为+7价 |
| A. | Z离子的结构示意图为: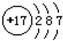 | B. | 分子TY2的键角为180° | ||
| C. | T元素在周期表中的表示为: | D. | XZ3为非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com