
| A. | Na+、K+、OH-、Cl- | B. | Mg2+、Cu+、SO42-、Cl- | ||
| C. | K+、Ba2+、Cl-、HCO3- | D. | NH4+、Ba2+、Fe3+、SO42- |
科目:高中化学 来源: 题型:解答题
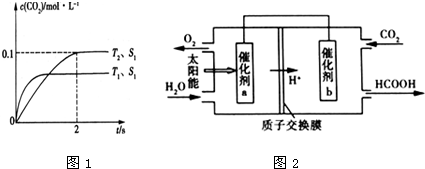
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NOx被还原 | B. | CO是还原剂 | ||
| C. | NOx反应中得到电子 | D. | CO发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | Si-O | O═O | Si-Si |
| 键能/kJ•mol-1 | x | 498.8 | 176 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国明代医学家李时珍所著的医学名著是<<神农本草经>> | |
| B. | 麻黄碱是国际奥委会严格禁止使用的兴奋剂 | |
| C. | 毒品就是有毒的药品 | |
| D. | 表示非处方药,表示处方药 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:
硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓溶液的导电能力一定很强 | |
| B. | 胶体带有同种电荷 | |
| C. | 离子反应中必有离子的数目在改变 | |
| D. | 氧化剂和还原剂不可能是同一种物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com