
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
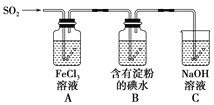
(1)A装置中发生反应的离子方程式为_________________________________________。
(2)B装置中发生反应的离子方程式为_________________________________________。
(3)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(4)装置C的作用是__________________________________________________。
(5)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(6)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是____________________________________。
【答案】 SO2+2Fe3++2H2O=2Fe2++SO42-+4H+ SO2+I2+2H2O=2I-+SO42-+4H+ BD 吸收多余的二氧化硫,防止污染空气 BF 方案① SO2也能使酸性高锰酸钾溶液褪色
【解析】(1)A装置中SO2通入溶液中,二氧化硫有还原性,FeCl3有氧化性,二氧化硫能与FeCl3发生氧化还原反应,离子方程式:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+ ;
(2)B装置中SO2通入溶液中,二氧化硫有还原性,碘有氧化性,二氧化硫能与碘发生氧化还原反应,离子方程式:SO2+I2+2H2O=2I-+SO42-+4H+ ;
(3)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错;B、浓硫酸虽具有强氧化性性,但不能氧化亚硫酸钠,故B正确;C、固体硫在纯氧中燃烧,操作不容易控制,故C错;D、Cu+2H2SO4( 浓 )![]() CuSO4+SO2↑+2H2O,故D正确。
CuSO4+SO2↑+2H2O,故D正确。
(4)、二氧化硫是酸性氧化物具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫。
(5)蒸发使用仪器:蒸发皿、漏斗、烧杯、玻璃棒,这一系列操作中没有用到的仪器 B.石棉网和F.坩埚
(6)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色, Fe2+也使高锰酸钾溶液褪色,故答案为:方案①,因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色。


科目:高中化学 来源: 题型:
【题目】已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是( )
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明H2O2既有氧化性又有还原性
D.实验③证明氧化性:Cr2O![]() >I2
>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是
A.非金属性:F > S > Cl B.原子半径:Cl > S > F
C.稳定性:HF > HCl > H2S D.酸性:HClO4 > H2SO4
He | ||
F | ||
S | Cl | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意如图。下列有关该电池说法正确的是

A. B电极发生还原反应
B. A电极上发生的一个电极反应为:2Li++S8+2e-=Li2S8
C. 每生成1mol Li2S8转移0.25mol电子
D. 电子从B电极经过外电路流向A电极,再经过电解质流回B电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
2C(石墨,s)+O2(g)===2CO(g) ΔH=-222 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
则CO还原H2O(g)的热化学方程式为__________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池工作时的负极电极反应式:______________________________________________________________。
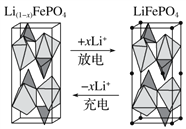
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应式:___________。
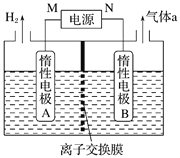
(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如下图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的_______(填“正”或“负”)极,B极区电解液为_______(填化学式)溶液,该离子交换膜是_______(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成细胞的元素和化合物的叙述中,正确的是
A. 原核细胞与真核细胞遗传物质的碱基种类相同
B. 细胞中的能源物质包括糖类、脂质、蛋白质和核酸
C. 细胞中含量最稳定的物质是核酸,其元素组成是C、H、O、N、P、S
D. 蛋白质的功能多样性导致蛋白质结构的多样性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母序号)
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因_______________。

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____________极(填“正”或“负”)。F电极上的电极反应式为_____________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因____________。
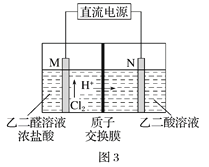
(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为______________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com