
【题目】(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则A和B的关系为__________。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是______________,其原因是_______________________。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是___________________;②若为弱酸强碱盐,其水解的离子方程式是____________________。
【答案】(1)A∶B=10-4∶1
(2)产生白色沉淀,且红色褪去在纯碱溶液中CO32-水解:CO32-+H2O![]() HCO3-+OH-,加入BaCl2后Ba2++CO32-===BaCO3↓(白色),由于CO32-的浓度减小,水解平衡左移,OH-浓度减小,酚酞褪色
HCO3-+OH-,加入BaCl2后Ba2++CO32-===BaCO3↓(白色),由于CO32-的浓度减小,水解平衡左移,OH-浓度减小,酚酞褪色
(3)①An++nH2O![]() A(OH)n+nH+②Bm-+H2O
A(OH)n+nH+②Bm-+H2O![]() HB(m-1)-+OH-
HB(m-1)-+OH-
【解析】(1)水的电离平衡为H2O![]() H++OH-。在NaOH溶液中,由于加入了OH-,水的电离平衡向逆反应方向移动,c(H+)减小;在pH=9的NaOH溶液中,c水(H+)=10-9 mol·L-1,其H+全部是水电离产生出来的;因为c水(H+)=c水(OH-),即c(A)=10-9 mol·L-1。在CH3COONa溶液中,由于CH3COO-离子结合了水中的H+,水的电离平衡向正反应方向移动,c(OH-)增大;在pH=9的CH3COONa溶液中,c(OH-)=1×10-5 mol·L-1,其OH-全部是水电离产生的,即c(B)=10-5 mol·L-1,所以,c(A)∶c(B)=10-9 mol·L-1∶10-5 mol·L-1=10-4∶1。(3)正确地表示An+、Bm-符号及Bm-水解产物HB(m-1)-至关重要。
H++OH-。在NaOH溶液中,由于加入了OH-,水的电离平衡向逆反应方向移动,c(H+)减小;在pH=9的NaOH溶液中,c水(H+)=10-9 mol·L-1,其H+全部是水电离产生出来的;因为c水(H+)=c水(OH-),即c(A)=10-9 mol·L-1。在CH3COONa溶液中,由于CH3COO-离子结合了水中的H+,水的电离平衡向正反应方向移动,c(OH-)增大;在pH=9的CH3COONa溶液中,c(OH-)=1×10-5 mol·L-1,其OH-全部是水电离产生的,即c(B)=10-5 mol·L-1,所以,c(A)∶c(B)=10-9 mol·L-1∶10-5 mol·L-1=10-4∶1。(3)正确地表示An+、Bm-符号及Bm-水解产物HB(m-1)-至关重要。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】已知在25 ℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡。当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的KW相似)。
如:AgX(s)![]() Ag+(aq)+X-(aq) Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
Ag+(aq)+X-(aq) Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
AgY(s)![]() Ag+(aq)+Y-(aq) Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
Ag+(aq)+Y-(aq) Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s)![]() Ag+(aq)+Z-(aq) Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
Ag+(aq)+Z-(aq) Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量的浓度表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为____________________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大“减小”或“不变”)。
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:________________。
②在上述(3)体系中,能否实现AgY向AgX的转化?根据你的观点选答一项。
若不能,请简述理由:____________________________________。
若能,则实现转化的必要条件是:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5molL﹣1 盐酸、0.55molL﹣1NaOH溶液,尚缺少的实验玻璃用品是、 .
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”).
(3)他们记录的实验数据如下:已知:Q=Cm(t2﹣t1),反应后溶液的比热容C为4.18kJ℃﹣1kg﹣1 , 各物质的密度均为1gcm﹣3 . ①计算完成下表.(保留小数点后一位)
序号 | 实验用品 | 溶液温度 | 中和热△H | ||
t1 | t2 | ||||
① | 50mL0.55molL﹣1NaOH | 50mL0.55molL﹣1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55molL﹣1NaOH | 50mL0.55molL﹣1HCl | 20℃ | 23.3℃ | |
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将(填“变大”或“变小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y. ①甲同学认为X中除Fe3+外还可能含有Fe2+ . 写出生成Fe2+所有可能的离子方程式: .
②乙同学取336ml(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: .
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为 .
(3)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g.计算放出H2的体积为升(标准状况下)
(4)向含有0.3mol NaAlO2的溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120ml 2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120ml)mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电﹣Fenton法是用于水体里有机污染物降解的高级氧化技术,其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH﹣+OH,生成的烃基自由基(OH)能氧化降解有机污染物.下列说法不正确的是( ) 
A.电源的A极是负极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O﹣e﹣=OH+H+ ,
D.消耗1molO2 , 可以产生4molOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
B. Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
C. NaCl与Na2CO3灼烧时火焰颜色不相同
D. Na2O2可作供氧剂,而Na2O不行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物含有C、H、O、N四种元素,下图是该有机物的球棍模型:
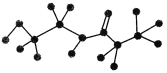
(1)该有机物的分子式为________,结构简式为__________________。
(2)该有机物可能发生的反应有________(填编号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应 ⑤酯化反应 ⑥缩聚反应
(3)该有机物发生水解反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2的分解反应为COCl2(g)Cl2(g)+CO(g).将一定量COCl2(g)和Cl2(g)放入一密闭容器中,2min时达到平衡后,各物质的量在不同条件下的变化情况如图所示.下列相关说法中不正确的是( ) 
A.1min时以CO表示的逆反应速率小于3min时以CO表示的正反应速率
B.若在6min时改变的条件为升高温度,则反应的平衡常数K增大
C.12min时改变的条件可为减小CO的浓度,16min时改变的条件可为增大反应容器的体积
D.以CO表示在4~5min、10~11min和12~13min时平均反应速率为v(4~5)<v(10~11)<v(12~13)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的一些常见单质,化合物等物质之间的转化关系中(有些反应过程中的水,部分产物和反应条件未全部列出),已知反应①是氯碱工业的最基础的反应,A、B、F、H、J的焰色反应均为黄色,热的F溶液可以去除物品表面的油污,I为地壳中含量最多的金属元素的单质,L是典型的两性氧化物,在常温常压下C、D、G均为气体,D呈黄绿色,G是形成温室效应的主要气体.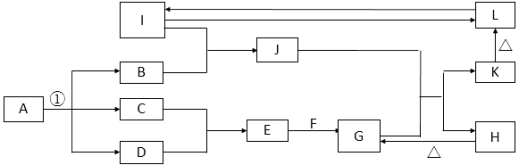
(1)反应①进行的条件为 .
(2)化合物F的化学式为 .
(3)I与氧化铁反应的化学方程式为 .
(4)J的水溶液与G反应生成K和H的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com