
分析 锌与稀硫酸的反应既是氧化还原反应,又是放热反应,实验室可将该反应设计成原电池,Zn为负极,电池工作时,负极上发生氧化反应,反应式为Zn-2e-=Zn2+,正极上发生还原反应,反应式为2H++2e-=H2↑,若有1mol电子流过导线,理论上正极产生的气体在标准状况下的体积是11.2L.
解答 解:锌与稀硫酸的反应既是氧化还原反应,又是放热反应,实验室可将该反应设计成原电池,Zn为负极,电池工作时,负极上发生氧化反应,反应式为Zn-2e-=Zn2+,正极上发生还原反应,反应式为2H++2e-=H2↑,若有1mol电子流过导线,根据电极反应,理论上正极产生的气体在标准状况下的体积是11.2L.故答案为:放热;Zn;2H++2e-═H2↑;11.2.
点评 本题考查原电池的基础知识,题目较为简单,注意原电池的组成和工作原理,利用电极方程式进行计算.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
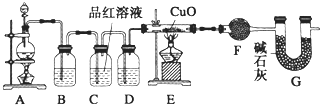
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,(若产物中有水生成则省略未表示出来).
,(若产物中有水生成则省略未表示出来).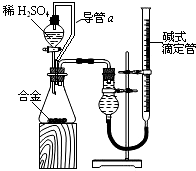
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式: | B. | 次氯酸分子的结构式:H-O-Cl | ||
| C. | Na的原子结构示意图: | D. | 钙离子的电子式:Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH3和 互为同分异构体 互为同分异构体 | |
| B. | 干冰和冰为同一种物质 | |
| C. | CH3CH3和CH3CH2CH3互为同系物 | |
| D. | 12C和14C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 有关信息 |
| X | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| Y | M层上有3个电子 |
| Z | 短周期元素中原子半径最大的主族元素 |
| W | 其单质是淡黄色固体 |
| Q | 最高正价与最低负价代数和为6 |
| A. | 简单离子的半径大小顺序为:W>Q>Z>Y | |
| B. | W单质在氧气中燃烧后的产物不能使品红溶液褪色 | |
| C. | X、W和氢三种元素形成的化合物中只有共价键 | |
| D. | Z与W元素只能形成原子个数比为2:1的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 240 | 250 | 260 | 270 |
| 平衡总压强/kp | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
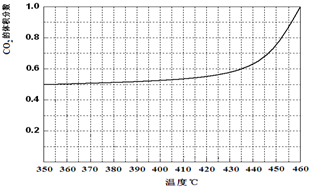
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 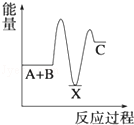 | B. |  | C. | 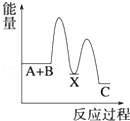 | D. | 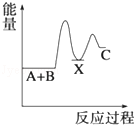 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com