
| A. | 氧化剂是Cl2 | |
| B. | 氧化剂与还原剂的物质的量之比为3:8 | |
| C. | 每生成1molN2,转移3mol电子 | |
| D. | 被氧化与未被氧化的NH3物质的量之比为1:3 |
分析 反应3Cl2+8NH3═N2+6NH4Cl中,Cl元素化合价降低,被还原,Cl2为氧化剂,N元素化合价升高,被氧化,NH3为还原剂,NH3与HCl反应生成氯化铵,有白烟生成,以此解答.
解答 解:A、反应中Cl2为氧化剂,NH3为还原剂,故A正确;
B、反应中Cl2为氧化剂,NH3为还原剂,由方程式可知,当有8molNH3参加反应,有2mol被氧化,则该反应中氧化剂与还原剂的物质的量之比为3:2,故B错误;
C、生成6mol NH4Cl有6mol×(1-0)=6mol电子转移,故C错误;
D、3Cl2+8NH3═6NH4Cl+N2反应中有8mol氨参加反应,2mol是还原剂,还有6mol未被氧化,所以被氧化与未被氧化的NH3物质的量之比为1:3,故D正确;
故选BC.
点评 本题以氨气的性质考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 将等体积、等物质的量浓度的CH3COONH4与CH3COONa溶液混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) | |
| B. | 将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) | |
| C. | 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) | |
| D. | 向0.10mol•L-1 Na2CO3溶液中通入少量CO2的溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 标准状况下气体的体积(mL) | 280 | 336 | 336 |
| A. | 甲、乙组的实验中,盐酸均是过量的 | B. | 盐酸的物质的量浓度为0.8mol L-1 | ||
| C. | 合金中镁、铝的物质的量之比为1:1 | D. | 丙组中铝的物质的量为0.0045mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
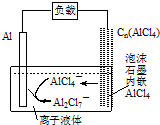 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl7-+Cl- | |
| B. | 放电时,电路中每流过3mol电子,正极减少27g | |
| C. | 充电时,泡沫石墨极与外电源的负极相连 | |
| D. | 充电时,阴极发生:4Al2Cl7-+3e-=Al+7AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
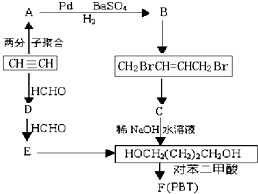 请根据以下知识解答
请根据以下知识解答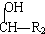 (R代表烃基,下同.)
(R代表烃基,下同.)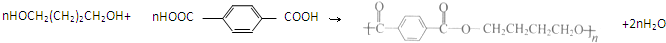 .
.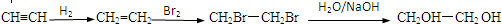 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)?2SO3(g)△H<0的影响如图所示,下列说法正确的是( )
在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)?2SO3(g)△H<0的影响如图所示,下列说法正确的是( )| A. | 反应b、c点均为平衡点,a点未达平衡且向正反应方向进行 | |
| B. | a、b、c三点的平衡常数Kb>Kc>Ka | |
| C. | 上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高 | |
| D. | a、b、c三点中,a点时SO2的转化率最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1 的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | 25℃,由水电离出的c(H+)=1×10-13mol/L 的溶液中:K+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、Cl- | |
| D. | 滴加紫色石蕊试液变红的溶液中:K+、Ba2+、Cl-、F- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com