
��֪���Ҵ���1,2�������顢���ѵ��й������������±���ʾ��
| �Ҵ� | 1,2�������� | ���� | |
| ͨ��״�� �µ�״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
| �ܶ�/g��cm��3 | 0.79 | 2.2 | 0.71 |
| �۵�/�� | ��130 | 9 | ��116 |
| �е�/�� | 78.5 | 132 | 34.6 |
ij��ѧС�������Ҵ������Ϊԭ����ʵ�����Ʊ�������1,2�������飬ʵ��װ����ͼ��ʾ(װ��A�еļ��Ȳ��ֵ�����װ��ʡ��û�л���)��
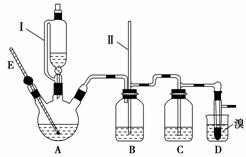
(1)����E��������_______________________________________________��
(2)����I��©�������IJ����ܵ�������________(����ĸ)��
a��ʹ©����Һ��������
b��������������������
c����ֹA��������ƿ���Һ�屬��
(3)ʵ��ʱ��A��������ƿ����뼸Ƭ���Ƭ��Ŀ����__________________��
���ȷ�Ӧ�����У�������ƿ���������ϩ�⣬���������ɵ��л���������Ҫ��__________________________________________________________________��
(4)��Ӧ�����У���B�г���������(II)���Һ����������˵������������________(�D�� ���ֶ�������C�������ѳ�����)��ɵġ�
(5)��Ӧ�����У� D��������ˮ��ȴʢ��Һ����Թܣ� ����ҪĿ����________��
˵���Ʊ�1,2��������ķ�Ӧ�Ѿ�������ʵ��������________________��
 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ���� �� ��
A��0.1mol��L��1��ˮ�У�c(OH��)=c(NH4+)
B��10 mL 0.02mol��L��1HCl��Һ��10 mL 0.02mol��L��1Ba(OH)2��Һ��ֻ��,����Ϻ���Һ�����Ϊ20 mL������Һ��pH=12
C����0.1mol��L��1CH3COONa��Һ�У�c(OH��)=c(CH3COOH)��c(H+)
D��0.1mol��L��1ij��Ԫ����ǿ����NaHA��Һ�У�c(Na��)=2c(A2��)��c(HA��)��c(H2A)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й����л����˵����ȷ����(����)
A���Ҵ������ᡢ�����������ܷ���ȡ����Ӧ���Ҷ���ͬ���칹��
B�����͡�ú�͡�ֲ���;�Ϊ��̼��������Ԫ�صĻ�����
C����ά�غ͵��۶��ܷ���ˮ�⣬��ˮ������ղ��ﲻͬ
D�����������������̼ԭ�������һ������ͬ���칹����ȴ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�����л���C8H16O2��ϡ���������¼��ȵõ�M��N�������ʣ�N���������տɵ�M����������л���Ľṹ������(����)
A��1�֡��������������� B��2��
C��3�� D��4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ�������ֵ����������������ȷ���� �� ��
��12.4g�������к��е�P��P����Լ��0.6 NA
�ڵ�⾫��ͭʱת����NA�����ӣ������ܽ�32 gͭ
��7.8 g Na2S��Na2O2�Ļ�����к��е�������������0.1 NA
��2mol SO2��1 mol O2�����V2O5���ڵ����������ܱ������м��ȷ�Ӧ������������
����������2 NA
��2.9g 2CaSO4��H2O���еĽᾧˮ������Ϊ0.02 NA (2CaSO4��H2Oʽ��Ϊ290)
��0.2 mol H2SO4��Ũ����������ͭ��Ӧ������SO2�ķ�����Ϊ0.1 NA
�ߺ�0.1mol����Na2CO3����Һ�У�������������������0.1NA
A���٢ڢۢܢݢ� B���ڢۢݢ� C���٢ۢܢݢ� D���ۢܢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Ե������Ǵӷ仨��ֲ������ȡ�õ����������ʣ���ṹ����ͼ������������ȷ���ǣ� ��
A���Ե����������û������̼ԭ��
B��1mol�Ե���������ܺ�9mol���������ӳɷ�Ӧ
C���Ե�������Է���ˮ�ⷴӦ��ȡ����Ӧ��������Ӧ
D��1mol�Ե���������ܺͺ�5mol NaOH��ˮ��Һ��ȫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����л����������ȷ���� �� ��
A. 1,2���������� B. 2���һ�����
C. 3,4���������� D. 3��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ȼ��1 g��Ȳ���ɶ�����̼��Һ̬ˮ���ų�����50 kJ������һ��Ӧ���Ȼ�ѧ��Ӧ����ʽΪ(����)
A��2C2H2(g)��5O2(g)===4CO2(g)��2H2O(l)
��H����50 kJ��mol��1
B��C2H2(g)��5/2O2(g)===2CO2(g)��H2O(l)
��H����1 300 kJ
C��2C2H2��5O2===4CO2��2H2O����H����2 600 kJ
D��2C2H2(g)��5O2(g)===4CO2(g)��2H2O(l)
��H����2 600 kJ��mol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com