
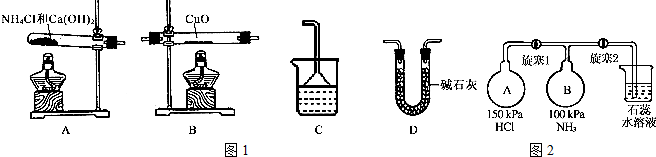
分析 (1)①氨气与氧化铜反应生成铜、氮气和水;
②根据题干可知需测定生成水的质量,生成的氨气需先通过碱石灰干燥、再在与氧化铜反应,最后用碱石灰吸收生成的水,以测得生成水的质量;
③由反应方程式可知氧化铜和水的物质的量相等,列出关系式计算即可;
④根据Ar(Cu)=$\frac{18a}{b}$,从是否影响a或b来分析误差;
(2)①根据A、B容器压强以及A、B混合后压强相等以及氨气和氯化氢反应生成氯化铵分析;
②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,氯化铵为强酸弱碱盐,溶液呈酸性,据此分析;
解答 解:(1)①氨气与氧化铜反应生成铜、氮气和水,化学方程式:2NH3+3CuO$\frac{\underline{\;加热\;}}{\;}$3Cu+3H2O+N2;
故答案为:2NH3+3CuO$\frac{\underline{\;加热\;}}{\;}$3Cu+3H2O+N2;
②因为需要测定反应后生成物水的质量,所以必需保证通入的氨气是纯净干燥的,由于浓硫酸可以与氨气反应,因此只能通过碱石灰进行干燥,再通入氧化铜进行反应,最后在通入碱石灰吸收反应生成的水,以测得生成水的质量,所以正确的顺序为A→D→B→D→C;
故答案为:D→B→D→C;
③根据反应方程式
2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2;
3 3
可知氧化铜和水的物质的量相等,所以有以下关系式:$\frac{a}{Ar(Cu)+16}$=$\frac{b}{18}$,
解得Ar(Cu)=$\frac{18a-16b}{b}$=$\frac{18a}{b}$-16,
故答案为:$\frac{18a}{b}$-16;
④由③可知得Ar(Cu)=$\frac{18a}{b}$-16,
A.若Cu0未完全起反应,说明b偏小,结果偏大,故A选;
B.若CuO不干燥,说明a偏小,b偏大,结果偏低,故B不选;
C.若Cu0中混有不反应的杂质,说明b偏小,结果偏大,故C选;
D.若NH4C1与Ca(OH)2混合物不干燥,但只要氨气干燥彻底,对结果不影响,故D不选;
故选:AC;
(2)①A容器压强为150KPa,B容器压强100KPa,A容器压强大于B容器,先打开旋塞1,A容器中的氯化氢进入B容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以B瓶中的现象是出现白烟,
故答案为:出现白烟;A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟;
②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,再打开旋塞2,紫色的石蕊试液倒吸入B瓶中,氯化铵为强酸弱碱盐,溶液中铵根离子水解生成一水合氨和氢离子,水解方程式为:NH4++H2O?NH3•H2O+H+,溶液呈酸性,所以紫色石蕊试液变红,
故答案为:烧杯中的石蕊溶液会倒流进入B瓶中,形成红色溶液;
点评 本题主要考查氨气的制备、净化、干燥和利用方程式进行的计算以及有关误差分析,明确实验原理和物质的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有一定有CO32- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ | |
| C. | 加入硝酸银溶液有白色沉淀产生,则一定有Cl- | |
| D. | 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 红热的铁丝与水接触表面形成蓝色保护层 | |
| D. | 在铁与稀H2SO4反应时,改用铁粉,可加快H2的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
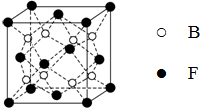 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.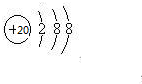 ,X的化学式Na3AlF6.
,X的化学式Na3AlF6.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com