
| A. | 平均相对分子质量 | B. | SO3(g)的转化率 | ||
| C. | $\frac{c(S{O}_{3})}{c(S{O}_{2})}$ | D. | c2(SO3) |
分析 恒容的密闭容器中,保持温度不变,再充入相同体积的SO3(g),n增大,则气体的压强增大,增大压强平衡逆向移动,以此来解答.
解答 解:A.再充入相同体积的SO3(g),相当于原平衡体积缩小一半,压强增大,当质量不变时,n减小,则平均相对分子质量增大,故A不选;
B.再充入相同体积的SO3(g),n增大,则气体的压强增大,增大压强平衡逆向移动,则SO3(g)的转化率减小,故B选;
C.平衡逆向移动,$\frac{c(S{O}_{3})}{c(S{O}_{2})}$中分子增大,分母减小,则比值增大,故C不选;
D.K只与温度有关,与浓度、压强无关,则K不变,故D不选;
故选B.
点评 本题考查化学平衡移动,为高频考点,把握压强与物质的量的关系、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
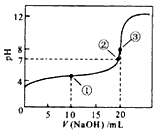 (1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.
(1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a% | B. | $\frac{3}{4}$a% | C. | $\frac{6(1-a%)}{7}$ | D. | $\frac{12(1-a%)}{13}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5mol | B. | 4.5mol | C. | 1.5mol | D. | 0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
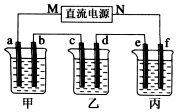 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
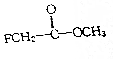 氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )| A. | 它含有两种官能团 | B. | 它属于卤代烃 | ||
| C. | 它能发生水解反应 | D. | 它属于烃的衍生物. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com