
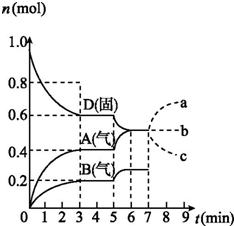
 在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )| A. | 从反应开始到第一次达到平衡时,B物质的平均反应速率为0.033 3 mol/(L•min) | |
| B. | 根据右图该反应的平衡常数表达式为K=c2(A)•c(B) | |
| C. | 若在第5 min时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 | |
| D. | 若在第7 分钟时增加D的物质的量,A的物质的量变化情况符合a曲线 |
分析 A、根据V=$\frac{△c}{△t}$进行计算;
B、根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
C、根据温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动;根据平衡常数只有与温度有关;温度升高化学反应速率加快;
D、增加固体的物质的量,浓度不变,平衡不移动.
解答 解:A、从反应开始到第一次达到平衡时,A物质的平均反应速率为$\frac{\frac{0.4mol}{2.0L}}{3min}$=0.067mol/L•min,所以v(B)=$\frac{1}{2}$v(A)=0.033 3 mol/(L•min),故A正确;
B、根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)?2A(g)+B(g); 因D为固体,所以化学平衡常数K=C2(A)×C(B),故B正确;
C、温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,平衡常数只有与温度有关,温度升高,平衡正向移动,平衡常数增大;温度升高化学反应B的反应速率加快,故C正确;
D、D为固体,增加D的物质的量,浓度不变,平衡不移动,A的物质的量变化情况符合b曲线,故D错误;
故选D.
点评 本题考查了化学平衡、平衡常数的影响因素,平衡计算分析应用,掌握基础是关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
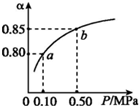 已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )
已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 该反应正反应是吸热反应 | |
| B. | 反应温度升高,A的转化率增大 | |
| C. | 平衡状态由a变到b时,化学平衡常数K(A)小于K(B) | |
| D. | 容器内气体的平均相对分子质量不变,说明反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
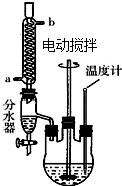 草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:
草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下: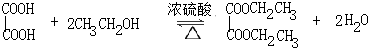 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中的金属都是以化合态形式存在的 | |
| B. | 工业上可利用反应:Mg+2KCl═MgCl2+2K↑进行金属钾的冶炼 | |
| C. | 利用潮汐发电是将化学能转化为电能 | |
| D. | 将海水蒸干可以直接获得食用盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应就是既能向正反应方向进行,又能向逆反应方向进行的化学反应 | |
| B. | 在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又分解生成二氧化硫和氧气,因此该反应是可逆反应 | |
| C. | 对于合成氨的反应,如果调控好反应条件,可使一种反应物的转化率达到100% | |
| D. | 碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这两个反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) | |
| B. | 0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.48L | B. | 5.6L | C. | 6.72L | D. | 8.96L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| B. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| C. | 含有0.1mo•L-1的Ca2+溶液:Na+、K+、CO32-、Cl- | |
| D. | 澄清透明的溶液中:Na+、K+、MnO4-、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com