
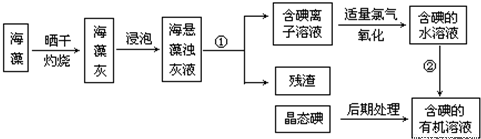
分析 (1)根据实验操作步骤灼烧来分析用到的实验仪器;
(2)分离固体和液体用过滤;用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来用萃取;萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多;
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,据此来选择合适的试剂;
(4)①根据氧化还原反应中得失电子数相等配平,根据I元素的变化分析;
②依据KIO3+5Kl+3H2SO4═3K2SO4+3I2+3H2O进行计算;
解答 解:(1)灼烧固体物质一般使用(瓷)坩埚,而瓷坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是,瓷坩埚、泥三角、酒精灯、坩埚钳;
故答案为:BDEF;
(2)分离固体和液体用过滤;利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取,将碘水中的碘单质萃取出来,选择合适的萃取剂即可,
故答案为:过滤;萃取(分液);
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应,酒精与水互溶,所以不能选用;
碘在四氯化碳中的溶解度大于在水中的溶解度,四氯化碳和水都不互溶,且四氯化碳和碘不反应,故可用四氯化碳,若得到的是含碘的四氯化碳溶液,静置后分层,下层为紫(红)色,分离互不相溶的液体用分液漏斗;
故答案为:A;酒精与水互溶;紫(红)色;
(4)①该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,KI为还原剂,一个KI失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,根据原子守恒配平为KIO3+5Kl+3H2SO4═3K2SO4+3I2+3H2O,反应中氧化产物和还原产物的质量比为5:1;
故答案为:5:1;
②KIO3+5Kl+3H2SO4═3K2SO4+3I2+3H2O
1 3
1.0×10-5 3.0×10-5
则50克食盐中含碘元素的物质的量为1.0×10-5mol,1000g食盐中碘元素物质的量为:1.0×10-5mol×20=2.0×10-4mol,1000g食盐中碘元素的质量为:2.0×10-4mol×127g/mol=254×10-4g=25.4mg,所以该食盐中碘元素的含量是25.4mg/kg,
故答案为:25.4.
点评 本题考查了物质的分离提纯方法、性质实验方案的设计与评价,题目难度中等,注意掌握物质分离与提纯方法,正确理解提纯原理为解答本题的关键,试题有利于培养学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基中含有的电子数为10NA | |
| B. | 22g CO2中含有共用电子对数4NA个 | |
| C. | 标准状况下22.4L氯仿(三氯甲烷)中共价键数目为4NA | |
| D. | 28g C2H4中含有2NA个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| C. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②③ | B. | ④①②③ | C. | ②④①③ | D. | ④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
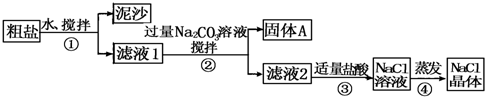
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | 有气泡冒出且烧杯中产生白色沉淀 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,加入硝酸酸化的硝酸钡溶液 | 产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 2a=b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com