
����Ŀ����������(NaClO2)��һ����Ҫ�ĺ�������������Ҫ����ˮ�������Լ�ɰ�ǡ���֬��Ư����ɱ���������ǹ������ⷨ�����������ƵĹ�������ͼ��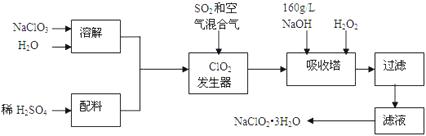
��֪����NaClO2���ܽ�����¶����߶������ʵ������¿ɽᾧ������ƷNaClO23H2O��
�ڴ�ClO2�ֽⱬը��һ����ϡ����������ϡ�͵�10�����¡�
��1���������з�����Ӧ�����ӷ���ʽΪ���������й�����������ÿ�������
a.��SO2������SO3 �� ��ǿ���� b.��NaClO3��ԭΪClO2 c.ϡ��ClO2�Է�ֹ��ը
��2���������ڷ�����Ӧ�Ļ�ѧ����ʽΪ���������ڵ��¶Ȳ��ܳ���20�棬��Ŀ������
��3����������Ϊ��ֹNaClO2����ԭ��NaCl�����û�ԭ���Ļ�ԭ��Ӧ���С����»�����ѡ��Ļ�ԭ����(ѡ�����)��
a.Na2O2 b.Na2S c.FeCl2
��4������Һ�еõ�NaClO2��3H2O�־����ʵ�������������
��5��ijѧϰС���õ������ⶨ�ֲ�Ʒ���������Ƶĺ�����ʵ�����£�
a.ȷ��ȡ��������������Ʒm g��С�ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���250 ml������Һ��(��֪��ClO2��+4I��+4H+=2H2O+2I2+Cl��)
b.��ȡ25.00 ml������Һ����ƿ�У��Ӽ��ε�����Һ����c mol��L-1 Na2S2O3��Һ�ζ����յ㣬�ظ�2�Σ����ƽ��ֵΪV ml ��(��֪��I2+2S2O32-=2I��+S4O62��)
�ٴﵽ�ζ��յ�ʱ������Ϊ ��
�ڸ���Ʒ��NaClO2����������Ϊ (�ú�m��c��V�Ĵ���ʽ��ʾ������������)
���𰸡�
��1��2ClO3����SO2��2ClO2��SO42����c
��2��2NaOH+2ClO2+H2O2��2NaClO2+2H2O+O2������ֹH2O2�ֽ�
��3��a
��4������Ũ������ȴ�ᾧ������
��5���μ����һ��Һ��ʱ��Һ����ɫ�����ɫ�Ұ�����ڲ���ɫ��22.625cV/m %
���������⣺��1��ClO2��������NaClO3��SO2����������ԭ��Ӧ����ClO2��Na2SO4 �� �䷴Ӧ�����ӷ���ʽΪ��2ClO3-+SO2=2ClO2+SO42-��
����Ϣ�ڿ�֪����ClO2�ֽⱬը��һ����ϡ����������ϡ�͵�10%���°�ȫ���������й������������Ӧ��ϡ��ClO2�Է�ֹ��ը��
���Դ��ǣ�2ClO3-+SO2=2ClO2+SO42-��c��
��2������������Ϣ��֪��������������NaClO2 �� ����һ����ClO2��NaClO2 �� ���ϼ۽��ͣ�����ԭ����H2O2�ض�����������������������Ӧ����ʽΪ��2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2����
H2O2���ȶ����¶ȹ��ߣ�H2O2���ֽ⣬���������¶Ȳ��ܳ���20�棬��Ŀ���Ƿ�ֹH2O2�ֽ⣬
���Դ��ǣ�2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2������ֹH2O2�ֽ⣻
��3����ԭ��Ҫ���У���ԭ��̫ǿ���ὫClO2��ԭΪ���ͼ�̬���Ӱ��NaClO2������������������ᴿ�������Լ����ܸ��ź���������Na2O2����ˮ�൱��H2O2��Na2S��FeCl2��ԭ�Խ�ǿ������������NaClO2����Ƚ����ѣ�
���Դ��ǣ�a��
��4������Һ�еõ����ᾧˮ�ľ��壬ֻ�ܲ�ȡ������Ũ������ȴ�ᾧ������ͨ�����˵õ��־��壬
���Դ��ǣ�����Ũ������ȴ�ᾧ�����ˣ�
��5������Ϊ����Na2S2O3��Һ�ζ����յ㣬��Ӧ��I2+2S2O32-=2I-+S4O62- �� I2��ָʾ�����۲�����ɫ�����յ��ǵμ����һ��Һ��ʱ��Һ����ɫ�����ɫ�Ұ�����ڲ���ɫ��
���Դ��ǣ��μ����һ��Һ��ʱ��Һ����ɫ�����ɫ�Ұ�����ڲ���ɫ��
���ɷ�Ӧ�е�IԪ���غ��֪��ClO2-��2I2��4 S2O32- �� 25.00mL������Һ��n��NaClO2��=![]() ��cV��10-3mol��m��NaClO2��=
��cV��10-3mol��m��NaClO2��=![]() ��90.5cV��10-3g����Ʒmg���250mL������Һ�е�NaClO2��������10��������Ʒ��NaClO2����������Ϊ
��90.5cV��10-3g����Ʒmg���250mL������Һ�е�NaClO2��������10��������Ʒ��NaClO2����������Ϊ![]() =
=![]() ��
��
���Դ��ǣ�![]()



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȸʯ��Ҫ��Cu2��OH��2CO3 �� ��������FeO��SiO2 �� �Կ�ȸʯΪԭ�Ͽ��Ʊ�CuSO45H2O�������£� 
��1��д����ȸʯ��ϡ���ᷴӦ�Ļ�ѧ����ʽ�� �� Ϊ�����ԭ�Ͻ������ʣ��ɲ�ȡ�Ĵ�ʩ����д����������
��2����ҺA�Ľ���������Cu2+��Fe2+ �� ʵ�鲽�����Լ������ѡ������ţ�
a��KMnO4 b��Cl2 c��H2O2 d��HNO3
��3����ҺB�м���CuO������ ��
��4��������Fe��OH��3��Ksp=1��10��39 �� ��Ҫ����Һ�е�Fe3+ת��ΪFe��OH��3������ʹ��Һ��c��Fe3+��������1��10��3mol/L�����轫��ҺpH������ ��
��5������ҺC���CuSO45H2O���壬��Ҫ�������ˣ�
��6������KMnO4����Һ�ⶨ��ҺA��Fe2+��Ũ�ȣ���ȡA��Һ20.00ml����0.010mol/L����KMnO4����Һ�ζ�������KMnO410.00ml��A��Һ��Fe2+�����ʵ���Ũ��mol/L��
����Ӧԭ����MnO4��+5Fe2++8H+�TMn2++5Fe3++4H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1molij������������������ȫȼ�գ����ɵ�CO2��ˮ��0.6mol��������ķ���ʽΪ ��
����������ʹ��ˮ����������Һ��ɫ������һ�������£����Ժ�Һ�巢��ȡ����Ӧ����һ��ȡ����ֻ��һ�֣���������������ṹ��ʽΪ �� ������ ��
��������ʹ��ˮ��ɫ�������ڴ�����������H2�����ӳɷ�Ӧ������2.2���������飬��������������ṹ��ʽΪ �� ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ��1g��Ȳ���ɶ�����̼��Һ̬ˮ�ų�����50kJ���������Ȼ�ѧ����ʽ��д��ȷ���ǣ� ��
A.2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H=+50 kJ?mol��1
B.C2H2��g��+ ![]() O2��g���T2CO2��g��+H2O��l����H=��1 300 kJ
O2��g���T2CO2��g��+H2O��l����H=��1 300 kJ
C.2C2H2+5O2�T4CO2+2H2O��H=��2 600 kJ
D.2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H=��2 600 kJ?mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeCl3��CuCl2���Һ�У�������������ۣ���ַ�Ӧ����Һ�еĽ�������
A. Fe2+ B. Fe3+ ��Fe2+ C. Cu2+ ��Fe2+ D. Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʣ����Ҵ����ڱ��ӣ�����ȩ���ܱ�ϩ��(CH2��CHCOOH)����������������������ˮ��KMnO4������Һ��NaHCO3��Һ���ܷ�Ӧ����(����)
A. �٢�B. �ڢ�C. ��D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��ȡ��M��ͨ�����·�Ӧʵ��ͭ���ӵĸ�����
��1��X������ˮ���������л��ܼ����侧������Ϊ��
��2��X����sp2�ӻ���sp3�ӻ���ԭ�ӵĵ�һ�������ɴ�С˳��Ϊ��
��3��������Ӧ�ж��Ѻ����ɵĻ�ѧ����������ţ���
a.���Ӽ� b.��λ�� c.������ d.���»��� e.���ۼ�
��4��M��W�����ӽṹ��ͼ����ȣ�M��ˮ����С��������Cu2+����ȡ��Mˮ����С����Ҫԭ������
��5������ͭ���壬�׳����������������д��£�����ⶾ�ȹ�Ч��ȡ5.0 g������Ʒ�������¶�ʹ��ֽ⣬�ֽ���̵��������±����ش��������⣺
�¶ȷ�Χ/�� | ��������/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000���� | 1.44 |
��ͼ������ͭ����ֽ�õ�һ���¶ȵIJ���ľ���(����ͺ��������ͬ��ԭ��)��
�ٸ��¶�����
��ͭԭ�ӵ���λ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ڢ�A��Ԫ�ص�ԭ������Ϊx����ͬ���ڵĢ�A��Ԫ�ص�ԭ��������( )
A. ֻ��x+1 B. ������x+8��x+18
C. ������x+2 D. ������x+1��x+11��x+25
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� �г���A��Rʮ��Ԫ�������ڱ���λ�ã�
���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
��1������ʾʮ��Ԫ���У�����õĽ���Ԫ���� �� ������Ԫ�ط��ţ�
��2������ʾʮ��Ԫ���У�ԭ�Ӱ뾶��С���� �� ԭ�Ӱ뾶��������������Ԫ�ط��ţ�
��3��CԪ�������ڱ��е�λ�ã� ��
��4��д��EF2���ӵĵ���ʽ ��
��5��H��I��G����Ԫ�ص��������Ӧ��ˮ�����������ɴ�С��˳������Ϊ �� ���ѧʽ����
��6��д��G�ĵ�����A������������Ӧˮ���ﷴӦ�����ӷ���ʽ ��
��7��E���ʺ�R������������Ӧˮ�������Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com