
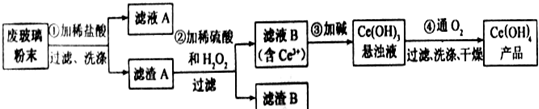
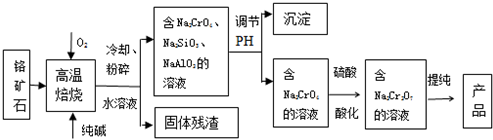
分析 ①CeO2、SiO2、Fe2O3等中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;②加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;③加入碱后Ce3+转化为沉淀,④通入氧气讲Ce从+3氧化为+4,得到产品,
(1)根据滤渣A上含有FeCl3;取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,反之,未洗净;
(2)根据氧化还原反应中电子得失守恒来分析;滤渣B为SiO2;
(3)萃取剂与水不互溶,结合萃取需要的仪器分析;
(4)根据电子守恒建立关系式:Ce(OH)4~FeSO4,然后进行计算求出Ce(OH)4的质量,最后求出质量分数.
解答 解:①CeO2、SiO2、Fe2O3等中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;②加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;③加入碱后Ce3+转化为沉淀,④通入氧气讲Ce从+3氧化为+4,得到产品,
(1)滤渣A上含有FeCl3,洗涤滤渣A的目的是为了除去Fe3+、Cl-;取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,反之,未洗净;
故答案为:Fe3+、Cl-;取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,反之,未洗净或取最后洗涤液少量,滴加AgNO3,如无白色沉淀,则洗干净;
(2)稀硫酸、H2O2,CeO2三者反应生成转化为Ce2(SO4)3、O2和H2O,反应的离子方程式为:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;加入稀硫酸和H2O2,CeO2转化为Ce3+,SiO2不反应,滤渣B的成分为SiO2,
故答案为:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;SiO2;
(3)化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,所以TBP不能与水互溶,故答案为:不能;分液漏斗;
(4)用0.1000mol/LFeSO4溶液滴定至终点,铈被还原成Ce3+,则Fe2+被氧化为Fe3+,则
Ce(OH)4~FeSO4
0.002mol 0.1000mol/L-1×0.020L
所以m(Ce(OH)4)=0.002mol×208g/mol=0.416g,
产品中Ce(OH)4的质量分数为$\frac{0.416}{0.500}×100%$=83.20%,
故答案为:83.20%.
点评 本题以工艺流程为基础,考查化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识,题目难度中等,明确实验流程及反应原理为解答关键,试题有利于培养学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:选择题
| 研究目的 | 温度(T) 对反应的影响 | 压强(p)对平衡常数的影响 | 压强(p)对反应的影响(p2>p1) | 温度(T)对反应的影响(T1>T2) |
| 图示 | 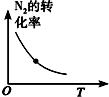 | 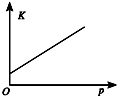 | 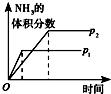 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| C. | 加水稀释CH3COONa溶液,溶液中$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$的值变小 | |
| D. | 25℃时,pH=4的盐酸与pH=4的醋酸溶液等体积混合后pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
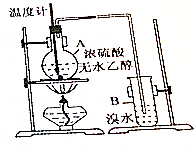 已知乙醇与浓硫酸加热到170℃时可生成乙烯:
已知乙醇与浓硫酸加热到170℃时可生成乙烯:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
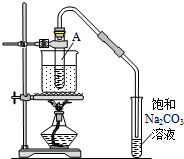 按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )
按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )| A. | 试管A中没有发生反应 | |
| B. | 热源小、水量多,水浴升温速度太慢 | |
| C. | 产物蒸汽在试管A上部全部被冷凝回流 | |
| D. | 产物已全部溶解在饱和Na2CO3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
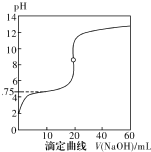 25℃时,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如右图所示.下列说法正确的是( )
25℃时,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如右图所示.下列说法正确的是( )| A. | 当滴人40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| B. | 当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+) | |
| C. | 当滴人NaOH溶液20mL时c(OH-)>c(H+)+c(HA) | |
| D. | 当滴定到pH=4.75时,c(A-)=c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | B氨水和盐酸混合后溶液呈酸性,溶液中可能存在:c(NH4+)>c(Cl-) | |
| C. | 在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×0×10-amol/L和是1.0×10-bmol/L,在此温度时,水的离子积为1.0×10-(a+b) | |
| D. | 常温下,0.1mol/L酸HA pH=3,0.1mol/L 碱BOH pH=13,则盐BA溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol•L-1AgNO3溶液中加入20mL0.05mol•L-1KSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中滴加少量2mol•L-1Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol•L-1AgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol•L-1KI溶液中 | 出现黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com