
| A. | 碳酸氢钠与过量的氢氧化钙溶液反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| B. | 过氧化钠与水的反应:2 O22-+2H2O═4 OH-+O2↑ | |
| C. | 碳酸钙加入醋酸CO32-+2CH3COOH═CO2↑+2CH3COO-+H2O | |
| D. | 铁与稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ |
分析 A.氢氧化钙过量,反应生成碳酸钙沉淀、氢氧化钠和水;
B.过氧化钠不能拆开,应该保留化学式;
C.碳酸钙为难溶物,离子方程式中不能拆开;
D.铁与稀盐酸反应生成的是亚铁离子.
解答 解:A.碳酸氢钠与过量的氢氧化钙溶液反应,反应的离子方程式为:HCO3-+OH-+Ca2+═CaCO3↓+H2O,故A正确;
B.过氧化钠与水的反应生成氢氧化钠和氧气,正确的离子方程式为:2Na2O2+2H2O═4OH-+O2↑+4Na+,故B错误;
C.碳酸钙加入醋酸,碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.铁与稀盐酸的反应生成氯化亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故D错误;
故选A.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
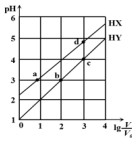 在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | a、b两点的溶液中:c(X-)>c(Y-) | |
| B. | 相同温度下,电离常数K(HX):d>a | |
| C. | 溶液中水的电离程度:d>c>b>a | |
| D. | lg$\frac{V}{{V}_{0}}$=2时,若同时微热两种液体(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$ 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
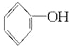 +2Na→2
+2Na→2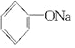 +H2↑
+H2↑ +3Br2→↓+3HBr
+3Br2→↓+3HBr +NaOH→
+NaOH→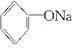 +H2O.
+H2O.| A. | ①和③ | B. | 只有② | C. | ②和③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷与2-甲基丙烷的一氯代物均为两种 | |
| B. | 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 | |
| C. | 乙醇和乙酸都能与碳酸氢钠溶液反应 | |
| D. | 富含糖类和蛋白质的物质都易被人体消化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L Na2 SO4 | B. | 150ml 1.5mol/LKAl (SO4)2 | ||
| C. | 500ml 0.3mol/L Fe SO4 | D. | 50ml 3mol/L Fe2 (SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为负极,二氧化锰为正极 | |
| B. | 锌为正极,二氧化锰为负极 | |
| C. | 工作时电子由二氧化锰经外电路流向锌极 | |
| D. | 锌电极发生还原反应,二氧化锰发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com