
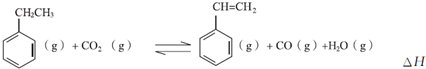

分析 Ⅰ.(1)①乙苯与CO2反应的平衡常数表达式为K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(2)①实验I乙苯在0-50min内浓度变化量为(1-0.4)mol/L=0.6mol/L,再根据v=$\frac{△c}{△t}$计算;
②实验Ⅱ与实验I相比,反应速率加快,但平衡不移动,应是加入催化剂;
③实验Ⅲ与实验I相比,反应速率加快,开始阶段相同时间内实验Ⅲ中苯乙烯的体积分数较大,但平衡时乙苯的浓度增大,平衡逆向移动,平衡时苯乙烯的体积分数小于实验I;
(3)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,等效压强增大到达平衡后在移走部分二氧化碳,增大压强平衡逆向移动,移走二氧化碳平衡逆向移动;
计算实验Ⅰ中平衡时时各组分的浓度,代入平衡常数K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})c(CO)c({H}_{2}O)}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})×c(C{O}_{2})}$计算;
Ⅱ.该反应正方向是气体体积增大的方向,正反应为吸热反应;根据温度、压强对平衡的影响分析;
解答 解:Ⅰ.(1)①乙苯与CO2反应的平衡常数表达式为K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})c(CO)c({H}_{2}O)}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})×c(C{O}_{2})}$,
故答案为:$\frac{c({C}_{6}{H}_{5}{CH=CH}_{2})?c(CO)?c({H}_{2}O)}{c({C}_{6}{H}_{5}{CH}_{2}{CH}_{3})?c({CO}_{2})}$;
②a.当反应达到平衡状态时,正逆反应速率相等(同种物质),v正(CO)=v逆(CO),反应达到平衡状态,故a正确;
b.c(CO2)与c(CO)的浓度是否相等,与反应的起始量和转化率有关,所以当c(CO2)=c(CO)时,不能说明已经达到平衡状态,故b错误;
c.消耗1molCO2为正速率,同时生成1molH2O也是正速率,都是正速率,二者始终相等,不能说明已经达到平衡状态,故c错误;
d.随着反应的进行CO2的体积分数逐渐减小,当CO2的体积分数保持不变,即是平衡状态,故d正确;故选bc.
故答案为:bc;
(2)①根据图I中可知,0-50min时乙苯的浓度变化为:1.0mol/L-0.4mol/L=0.6mol/L,则乙苯的反应速率v=$\frac{0.6mol/L}{50min}$=0.012mol/(L•min),
故答案为:0.012mol/(L•min);
②实验Ⅱ与实验I相比,反应速率加快,但平衡不移动,应是加入催化剂,故答案为:加催化剂;
③实验Ⅲ与实验I相比,反应速率加快,开始阶段相同时间内实验Ⅲ中苯乙烯的体积分数较大,但平衡时乙苯的浓度增大,平衡逆向移动,平衡时苯乙烯的体积分数小于实验I,则实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线为 ,
,
故答案为: ;
;
(3)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,等效压强增大到达平衡后在移走部分二氧化碳,增大压强平衡逆向移动,移走二氧化碳平衡逆向移动,故所以乙苯的转化率减小;
根据图I中实验1可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L
C6H5CH2CH3+CO2?C6H5CH=CH2 +CO+H2O
起始浓度(mol/L):1.0 3.0 0 0 0
反应浓度(mol/L):0.6 0.6 0.6 0.6 0.6
平衡浓度(mol/L):0.4 2.4 0.6 0.6 0.6
则平衡常数K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})c(CO)c({H}_{2}O)}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})×c(C{O}_{2})}$=$\frac{0.6×0.6×0.6}{0.4×2.4}$=0.225,
故答案为:减小;0.225;
Ⅱ.A.该反应的正方向为吸热反应,升温平衡向着正方向移动,乙苯的转化率升高,故A正确;
B.该反应的正方向为吸热反应,升温平衡向着正向移动,平衡常数增大,故B错误;
C.增大压强,正反应速率增大,故C正确;
D.该反应是体积增大的反应,增大压强,平衡向着逆方向移动,苯乙烯的转化率减小,故D正确.
故答案为:B.
点评 本题考查化学平衡影响因素、反应速率计算、化学平衡常数的计算,题目难度中等,作图为易错点,学生容易考虑到达平衡时间及苯乙烯体积分数,易忽略开始阶段相同时间内实验Ⅲ中苯乙烯的体积分数较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | 200 | 300 | 400 | 500 |
| K | 5×108 | 1.0 | 0.86 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
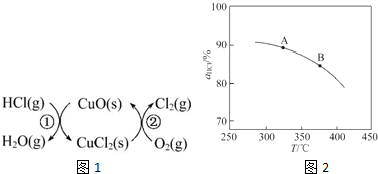
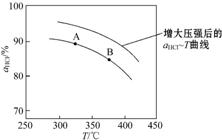 ,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑤ | C. | ①②④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “钴酞菁”的分子(直径为1.3×10-9m)在水中形成的分散系能产生丁达尔效应 | |
| B. | 氢氟酸可用细口玻璃试剂瓶保存 | |
| C. | 粘附有硫单质的试管可用酒精洗涤 | |
| D. | “地沟油”分馏可制得矿物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入CuSO4溶液中:2Na+Cu2+═2Na++Cu | |
| B. | 过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO | |
| C. | 向Mg(OH)2悬浊液中滴加四滴0.1mol•L-1FeCl3溶液:3Mg(OH)2(S)+2Fe3+(aq)═2Fe(OH)3(S)+3Mg2+(aq) | |
| D. | 铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com