
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀. | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色. | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生沉淀的转化,生成更难溶的物质;
B.滴加氯水后再加入KSCN溶液,亚铁离子可被氯气氧化;
C.溶液上层呈橙红色,可知氯气氧化溴离子;
D.加热氯化铵分解.
解答 解:A.发生沉淀的转化,生成更难溶的物质,由现象可知生成AgI沉淀,则Ksp(AgCl)>Ksp(AgI),故A错误;
B.滴加氯水后再加入KSCN溶液,亚铁离子可被氯气氧化,原溶液中可能含Fe2+,或含Fe3+,或二者均含,故B错误;
C.溶液上层呈橙红色,可知氯气氧化溴离子,由氧化还原反应中还原剂的还原性大于还原产物的还原性可知,Br-还原性强于Cl-,故C正确;
D.加热时氯化铵分解,在试管口HCl与氨气化合生成氯化铵,与升华无关,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握沉淀的转化、离子检验、物质的性质、现象与结论的关系、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )| A. | 能发生取代反应、加成反应、消去反应 | |
| B. | 1mol该物质中含有苯环的物质的量为1mol | |
| C. | 该物质在酸性条件下加热水解可以得到乙醇 | |
| D. | 与足量NaOH溶液反应,最多消耗4nmolNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 装置 | 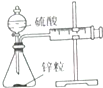 |  |  | 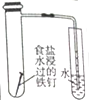 |
| 实验 | 结合秒表测量锌与硫酸的反应速率 | 石油的分馏 | 验证化学能转化为电能 | 铁的吸氧腐蚀实验 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
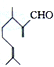 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(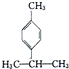 ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 对异丙基甲苯的分子式为C10H14 | |
| B. | 香叶醛的一种同分异构体可能是芳香醇 | |
| C. | 两者互为同分异构体 | |
| D. | 两者均能与溴水反应加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 元素Y分别与元素Z、W形成的化合物中化学键类型相同 | |
| C. | 元素Z和元素Y、W均能形成离子化合物 | |
| D. | 四种元素形成的氢化物中,沸点最高的是元素Y的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
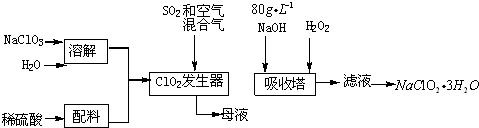
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
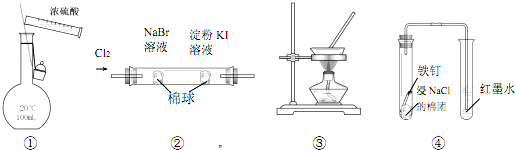
| A. | 图①装置可用于配制 100 mL 0.1 mol/L的硫酸 | |
| B. | 图②装置可证明氧化性:Cl2>Br2>I2 | |
| C. | 图③装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 图④装置可观察铁的吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com