
| A. | 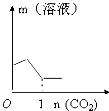 | B. | 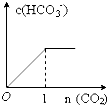 | C. | 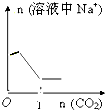 | D. | 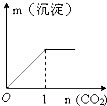 |
分析 碳酸钠饱和溶液中通入二氧化碳,发生反应Na2CO3+H2O+CO2=2NaHCO3,碳酸氢钠溶解度比碳酸钠的溶解度小,而且反应过程中又消耗了水,导致溶液中的溶剂质量减少,就会导致生成的碳酸氢钠过饱和而生成沉淀,据此解答.
解答 解:A.碳酸钠饱和溶液中通入二氧化碳,发生反应Na2CO3+H2O+CO2=2NaHCO3,溶液质量增加,当通入二氧化碳反应生成的碳酸氢钠达到其溶解度时,再通入二氧化碳反应生成的碳酸氢钠不能溶解,溶液质量减小,最后变为饱和碳酸氢钠溶液后保持不变,故A正确;
B.碳酸钠饱和溶液中通入二氧化碳,发生反应Na2CO3+H2O+CO2=2NaHCO3,碳酸氢根离子浓度增大,当生成的碳酸氢钠达到溶解度时,碳酸氢根离子浓度不再增大,通入二氧化碳的量小于1mol,故B错误;
C.饱和溶液中通入二氧化碳反应生成碳酸氢钠,继续通入,随着二氧化碳通入量增大,碳酸氢钠达到饱和,有沉淀析出,所以开始钠离子浓度不变,后来变小,最后碳酸钠完全转化为碳酸氢钠溶液,钠离子浓度又保持不变,故C错误;
D.刚开始为饱和碳酸钠溶液,没有沉淀析出,通入二氧化碳少量时发生反应Na2CO3+H2O+CO2=2NaHCO3,但是碳酸氢钠还为达到饱和,所以不会有沉淀析出,一段时间后生成的碳酸氢钠增大,达到饱和开始产生沉淀,故D错误,
故选:A.
点评 本题考查碳酸钠与碳酸氢钠的性质,明确二者化学性质及饱和溶液性质是解题关键,题目难度中等.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有一定有CO32- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ | |
| C. | 加入硝酸银溶液有白色沉淀产生,则一定有Cl- | |
| D. | 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
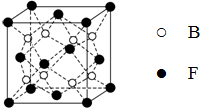 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.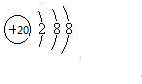 ,X的化学式Na3AlF6.
,X的化学式Na3AlF6.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| B. | 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面矿物油 | |
| C. | 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 | |
| D. | 钾(K)一般不用电解法制备,工业上可用Na与熔融KCl反应制K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水:Al3++3H2O?Al(OH)3↓+3H+ | |
| B. | 氯化铵溶于水:NH4++H2O?NH3•H2O+H+ | |
| C. | 亚硫酸溶液中:H2SO3?2H++SO32- | |
| D. | 在小苏打溶液中滴加氢氧化钠:HCO3-+OH-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温、常压下11.2L N2含有的分子数为0.5NA | |
| B. | 标况下,22.4LH2的分子数为NA | |
| C. | 标况下,18g水的体积是22.4L | |
| D. | 1molSO2的体积是22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com