
| A. | .①②⑤ | B. | .①③④ | C. | .③④ | D. | ③④⑥ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①消耗2mol SO2的同时生成2mol SO3,都体现的正反应方向,故错误;
②当体系达平衡状态时,SO2、O2与SO3的物质的量之比可能为2:1:2,也可能不等,与各物质的初始浓度及转化率有关,故错误;
③反应混合物中,SO3的质量分数不再改变,说明正逆反应速率相等,达平衡状态,故正确;
④恒容条件下压强保持不变,说明气体的物质的量不变,反应达平衡状态,故正确;
⑤一定体积下气体的密度一直保持不变,故错误;
⑥v正(SO2)=2v正(O2)=2v逆(O2),故正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键,共价化合物中可能含离子键 | |
| B. | 碘易升华是因为分子间的共价键较弱 | |
| C. | 构成单质分子的微粒一定含有化学键 | |
| D. | 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依原电池的原理设计出化学电源 | |
| B. | 原电池是化学电源的雏形 | |
| C. | 原电池输出电能的能力取决于组成原电池的负极材料的活泼性 | |
| D. | 氧化还原反应所释放出的化学能是化学电池的能量来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 草酸的体积(mL) | 温度 | 其他物质 |
| ① | 2Ml | 20 | 无 |
| ② | 2mL | 20 | 10滴饱和MnS04溶液 |
| ③ | 2mL | 30 | 无 |
| ④ | 1mL | 20 | 1mL蒸馈水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
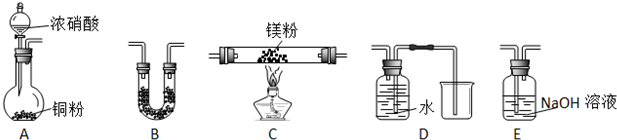
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
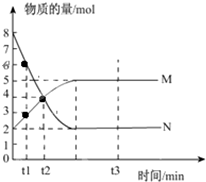 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
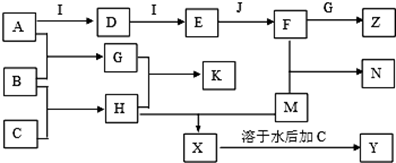
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com