
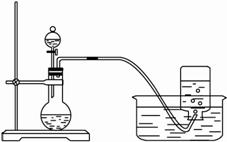
(1)将3.9 g过氧化钠放入烧瓶中,加入100 mLH2O,用排水法收集气体。?
①过氧化钠跟水反应的化学方程式为 。?
②集气瓶充满气体后,怎样从水槽中取出集气瓶?简述操作方法。?
。
(2)已知:酚酞在c(OH-)为1.0×10-4~2.5 mol·L-1时呈红色,且0.5 min内不会褪色;H2O2具有氧化性和漂白性。取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红,片刻红色褪去。?
①有人认为,“红色迅速褪去”是由于溶液中c(OH-)过大造成的,试通过估算并对比数据加以说明。
。
②还有人认为,“红色迅速褪去”是因为溶液中存在H2O2。试设计实验证明烧瓶内的溶液中可能有H2O2存在。请简述实验操作。?
。?
③补充实验,证明“红色迅速褪去”与溶液中存在H2O2有关。请简述实验操作。?
。
(1)①2Na2O2+2H2O=4NaOH+O2↑?
②用玻璃片在水面下盖住集气瓶口,将玻璃片与集气瓶一起移出水面,将盖有玻璃片的集气瓶正放在桌上。
(2)①经估算,烧瓶中c(OH-)约为1 mol·L-1;因为c(OH -)在1.0×10-4?~2.5 mol·L-1?时酚酞呈红色,因此红色迅速褪去不是由于溶液中c(OH-)过大造成的?
②取烧瓶中的溶液于试管中,加入少量二氧化锰,有气泡放出,用带火星的木条检验,木条着火,说明溶液中可能有H2O2存在?
③取②中试管里的溶液滴加酚酞试液,溶液变红且不褪色,说明“红色迅速褪去”与H2O2的存在有关??
解析:
(1)②用玻片在水下盖住瓶口一起移出水面,正放桌面。?
(2)①3.9克Na2O2产生n(OH-)=0.1 mol,故浓度c(OH -)在1 mol·L-1左右,故不可能是因c(OH-)过大造成的。?
②H2O2在MnO2存在下易分解放出气体,故可用加入MnO2的方法。?
③做对比实验,即在②操作后的试管中再加入酚酞,若变红不褪色,说明与H2O2有关。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
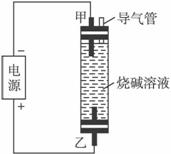
A.烧碱溶液注入容器前,需预先煮沸 B.甲电极上有氢气冒出
C.只能用铁作甲电极和乙电极 D.可用食盐水代替烧碱溶液
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市闸北区高三下学期二模化学试卷(解析版) 题型:实验题
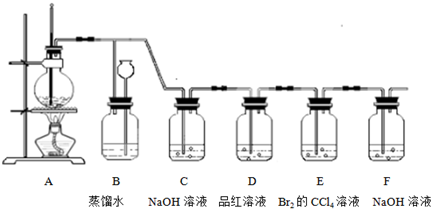
氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
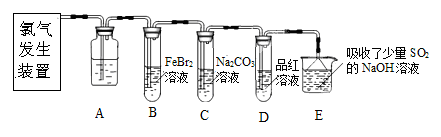
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
;
(2)装置A中盛有的试剂是 ,作用是 。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是 (填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32- 和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-。
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是 。
38.现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol/L H2SO4
b.0.01 mol/L KMnO4
c.1 mol/L BaCl2溶液
d.淀粉碘化钾溶液
e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B
两试管中。
步骤二:向A试管中滴加少量___________ (填序号),若溶液_________________(填现象),则假设
1成立。
步骤三:向B试管中滴加少量___________(填序号),若溶液_________________(填现象),则假设2
成立。
查看答案和解析>>
科目:高中化学 来源:2009-2010学年度唐山二中高二第二学期期中化学试卷 题型:实验题
(5分)实验室利用下图所示装置制取乙酸乙酯。请回答:
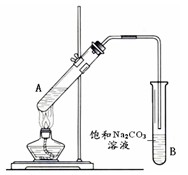
(1)试管A中盛放的试剂为乙酸、 和浓硫酸,它们之间发生反应生成乙酸乙酯的化学方程式为 。
(2)加热一段时间后,可观察到B试管中液面上有无色油状液体生成。B试管中的导管不伸入液面下的原因是 (填序号)。
①防止溶液倒吸 ②避免反应过快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com