
著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献.
①氟化氢(HF)的水溶液能雕刻玻璃.制备普通玻璃的主要原料有SiO2、CaCO3、 (填化学式).
②水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式 .
科目:高中化学 来源: 题型:
据报道,我国拥有完全自主产权的氢氧燃料电池车已经在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是( )
A.负极反应式为2H2+4OH--4e-====4H2O
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2====2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是( )
|
| A. | 氯化钠的电子式:Na: |
|
| B. | 乙烯的结构简式:C2H4 |
|
| C. | 硅的原子结构示意图: |
|
| D. | 硫酸的电离方程式:H2SO4=H22++SO42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
N2+3H2 2NH3是目前工业上合成氨的反应,下列关于该反应的说法正确的是( )
2NH3是目前工业上合成氨的反应,下列关于该反应的说法正确的是( )
|
| A. | 增加N2的浓度能加快反应速率 |
|
| B. | 降低体系温度能加快反应速率 |
|
| C. | 使用催化剂不影响反应速率 |
|
| D. | 若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,浓度均为0.1mol•L﹣1的4种钠盐溶液pH如下表:下列说法中正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 8.3 | 5.2 |
|
| A. | 足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO﹣=HClO+HSO3﹣ |
|
| B. | 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
|
| C. | 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3 |
|
| D. | NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3﹣)>c(SO32﹣)>c(OH﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
(1)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气.
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ/mol
CO(g)+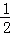 O2(g)=CO2(g)△H2=﹣283kJ/mol
O2(g)=CO2(g)△H2=﹣283kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g)△H3则△H3= kJ•mol﹣1.
(2)气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 .
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡,测得NO为8×10﹣4mol.计算该温度下的平衡常数K≈ .
(3)尾气中的CO主要来自于汽油不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)△H=+221kJ•mol﹣1,简述该设想能否实现的依据:
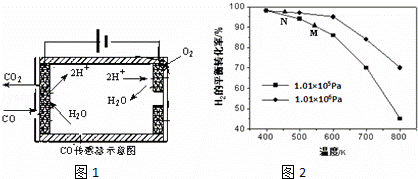
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用如图1简单表示,则阳极发生的电极反应为 .
(4)汽车尾气中的CO可转化为甲烷,方程式为CO(g)+3H2(g)⇌CH4(g)+H2O(g).其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图2所示.
①该反应的△H 0(填“<”、“=”或“>”).
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K时,实验测得溶液中的反应:H2O2+2HI====2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol·L-1·min-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol·L-1·min-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A.0.038 0 mol·L-1·s-1 B.0.152 mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)====2HCl(g) ΔH=-185 kJ·mol-1,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为_________。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
③2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
标准状况下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是__________。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)====CH4(g)的反应热ΔH为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com