
| A��ú̿ȼ��ʱ��������ˮ������ʹú̿ȼ�շų���������� |
| B����Ӧ2Na2O2+2H2O = 4Na++4OH-+O2���κ������¾����Է� |
| C����֪P4(����,s)="4" P(����,s); ��H =-29.2kJ��mol-1������ױȺ����ȶ� |
| D����֪H2�ı�ȼ����Ϊ285.8 kJ��mol-1����H2ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ�� |
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Na2CO3��Һ�м����������ʵ����ʵ����ı����ᣬ��Һ�д��ڣ� c(Na+) = c(CH3COOH) + c(CH3COO-)+ c(CO  )+c(HCO )+c(HCO ) + c(H2CO3) ) + c(H2CO3) |
| B��NaHCO3��Һ�д��ڣ�c(H+)+c(H2CO3)=c(OH-) |
| C��10 mL 1.0 mol��L-1CH3COOH��Һ�м���0.01 mol��NaOH����Һ������Ũ�ȵĴ�С��ϵΪ��c(Na+)=c(CH3COO-)��c(OH-)=c(H+) |
| D����ͬ�����£��к������pH����ͬ��HCl��Һ��CH3COOH��Һ�����ĵ�NaOH���ʵ���ǰ�ߴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
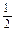 O2��g����H2O��l�� ��H="-285" kJ��mol-1
O2��g����H2O��l�� ��H="-285" kJ��mol-1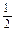 O2��g����H2O��g�� ��H="-241.8" kJ��mol-1 ��C��s�� +
O2��g����H2O��g�� ��H="-241.8" kJ��mol-1 ��C��s�� +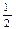 O2��g����CO��g�� ��H="-110.5" kJ��mol-1
O2��g����CO��g�� ��H="-110.5" kJ��mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 �أ��϶�������Ԫ��
�أ��϶�������Ԫ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1mol/LCH3COOH��Һ��ˮϡ�ͣ���Һ��c(OH-)���� |
| B����NaOH�Ͱ�ˮ��Һ��ϡ��һ�������ߵ�OH-Ũ�Ⱦ����ٵ�ԭ����1/2 |
| C����ͬŨ�ȵ�HCl��CH3COOH������Һ��c(H+)��ͬ |
| D������Һ��pH��5������Һ��pH��4�������Һ������Һ��c(H+)֮��Ϊ10��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��  |
B��  |
C��  |
D��  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH=3��pH=5�������10mL��ϣ�������Һ��pH=4 |
| B����Һ��c��H+��Խ��pHֵҲԽ����Һ�����Ծ�Խǿ |
| C��Һ����Ȼ�����磬���ܽ���ˮ��������ã���ˣ�Һ��Ҳ��ǿ����� |
| D�����¶Ȳ���ʱ���ڴ�ˮ�м���ǿ����Һ����Ӱ��ˮ�����ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��xΪ���ᣬVx��Vy |
| B��xΪǿ�ᣬVx��Vy |
| C��yΪ���ᣬVx��Vy |
| D��yΪǿ�ᣬVx��Vy |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com