
【题目】下列叙述正确的是
A. 明矾和漂白粉常用于自来水的净化和消毒,两者原理相同
B. 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小
C. 等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D. FeCl3与KSCN反应达到平衡时,加入KCl溶液,则溶液颜色变深
【答案】C
【解析】A,明矾溶于水电离出Al3+,Al3+发生水解生成Al(OH)3胶体,Al(OH)3胶体吸附水中的悬浮物,明矾用于净水,漂白粉的有效成分为Ca(ClO)2,Ca(ClO)2与CO2、H2O作用产生具有强氧化性的HClO,HClO用于杀菌消毒,原理不同,A项错误;B,由于H2S的一级电离远大于二级电离,S2-的水解能力大于HS-,等浓度的Na2S溶液的pH大于NaHS溶液,B项错误;C,NH4+在溶液中存在水解平衡:NH4++H2O![]() NH3·H2O+H+,NH4HSO4电离出NH4+、H+和SO42-,由于H+浓度增大,抑制NH4+的水解,等物质的量浓度的NH4Cl和NH4HSO4溶液中,NH4HSO4溶液中c(NH4+)大,C项正确;D,FeCl3与KSCN反应的离子方程式为Fe3++3SCN-
NH3·H2O+H+,NH4HSO4电离出NH4+、H+和SO42-,由于H+浓度增大,抑制NH4+的水解,等物质的量浓度的NH4Cl和NH4HSO4溶液中,NH4HSO4溶液中c(NH4+)大,C项正确;D,FeCl3与KSCN反应的离子方程式为Fe3++3SCN-![]() Fe(SCN)3,KCl不参与反应,加入KCl溶液,溶液的体积变大,各离子浓度变小,溶液颜色变浅,D项错误;答案选C。
Fe(SCN)3,KCl不参与反应,加入KCl溶液,溶液的体积变大,各离子浓度变小,溶液颜色变浅,D项错误;答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)我国首创以铝_空气_海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为_____________;正极材料是__________,正极反应为_______________。
(2)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。阳极反应式:2CO+2CO![]() -4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
-4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
(3)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______________。若改用AlCl3水溶液作电解液,则阴极产物为_________。
(4) “镁-次氯酸盐”燃料电池的装置如图所示,该电池的正极反应式为_________________。
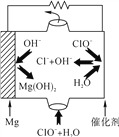
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
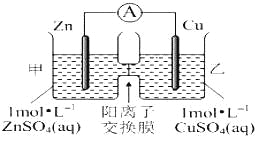
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中含Fe2+而不含有Fe3+,进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②观察到无现象 ③加入少量KSCN溶液
A.①③②B.③①②C.③②①D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min[ |
条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H__________0(填">","<"或"=")
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
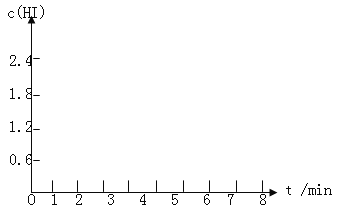
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为: LaNi5+Ni(OH)2![]() LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是
A.放电时镍被还原 B.放电时负极LaNi5H+OH——e—=LaNi5+H2O
C.充电时OH—向阴极移动 D.充电时每消耗lmol Ni(OH)2转移lmol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家可以通过__________法发现太阳存在有大量的铁元素,写出基态Fe原子的价电子排布图__________________。从结构上分析Fe3+比Fe2+稳定的原因:________________________。
(2)SCN-常用来检测Fe3+的存在,SCN-中心原子的杂化方式为_________,三种元素电负性由大到小的顺序为__________________。
(3)砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_________(填化学式),其理由是________________________。
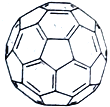
(4)C60分子又名足球烯,它是由60个碳原子组成的球状分子,右图为C60结构图。一个C60分子中六元环的数目为____________,在C60晶胞中C60分子的配位数为___________。已知C60分子的球体 半径为a nm,求C60晶体的ρ=_________g/cm3。(用NA表示阿伏加德罗常数,写出表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
)是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
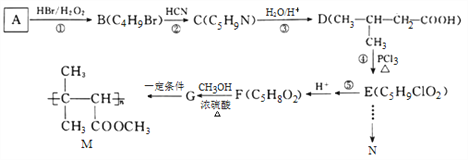
已知:I. ![]()
II. ![]()
请回答下列问题:
(1)A分子中共面的原子数最多为________个,-CN的电子式为_______________。
(2)②的反应类型为________________, E分子中所含官能团的名称为____________,G的结构简式为_____________________。
(3)写出反应⑤的化学方程式__________________________________________,写出M在酸性条件下水解的化学方程式_________________________________。
(4)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有______种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:____________________。
(5)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)_____________
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com