
分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算,化学反应中,反应物的总能量大于生成物的总能量,反应放热,反之吸热,以此计算反应热并判断吸热还是放热,反应热与化学计量数成正比,结合热化学方程式的书写规则书写该反应的热化学方程式.
解答 解:拆1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ,在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,
放出的热量为:2346kJ-2254kJ=92kJ,1mol N2(g)和3mol H2(g)完全转化为NH3(g)生成2mol NH3放出热量为92KJ,
所以该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
答:1mol N2(g)和3mol H2(g)完全转化为NH3(g)的反应热的理论值为92KJ;热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题主要考查了反应热的计算、热化学方程式的书写,注意把握从键能的角度计算反应热的方法,注意热化学方程式:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:选择题
| 实验步骤 | 实验用品 | |
| A | 步骤1:将海带灼烧灰化 |  |
| B | 步骤2:将海带灰溶解、过滤 |  |
| C | 步骤3:氧化滤液中的I- |  |
| D | 步骤4:检验碘元素 |  |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钙(CaO2)的电子式: | |
| B. | 816O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的系统名称是3,4-二甲基-3-乙基己烷
的系统名称是3,4-二甲基-3-乙基己烷 系统命名为4-甲基-2-戊炔
系统命名为4-甲基-2-戊炔
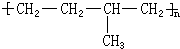 所示,形成该高聚物的单体的结构简式分别
所示,形成该高聚物的单体的结构简式分别查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KF的电子式: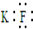 | |
| B. | 异丁烷的结构简式:CH3CH2CH2CH3 | |
| C. | 硫离子的结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的正极 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 反应2NH4++2e-=2NH3↑+H2↑在负极上发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
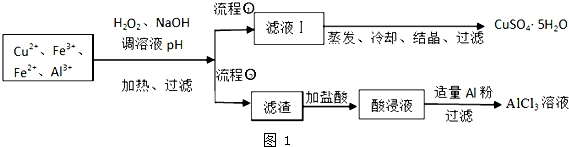
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com