
分析 根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写.
解答 解:(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,故答案为:1s22s22p63s23p63d64s2;
(2)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(3)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(4)Si元素为14号元素,原子核外有14个电子,所以核外电子排布式为:1s22s22p63s23p2,故答案为:1s22s22p63s23p2.
点评 本题考查了基态原子的核外电子排布式,核外电子排布规律来写,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验 编号 | HA物质的量 浓度(mol•L-1) | NaOH物质的量 浓度(mol•L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
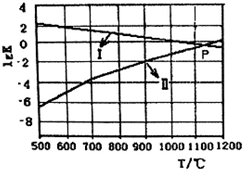 一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:
一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,可以减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率.相关的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
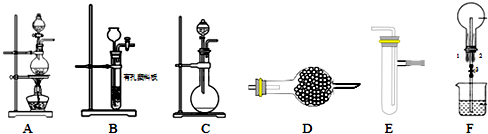
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
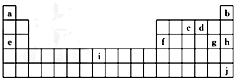
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | a+1=d-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
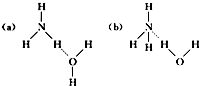
 ,离子键,共价键;
,离子键,共价键;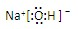 ,离子键,共价键;
,离子键,共价键; ;共价键;
;共价键; ,共价键,离子键.
,共价键,离子键.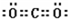 ;共价键;
;共价键; ;共价键.
;共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com