
分析 (1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
根据盖斯定律,(②-①×2-③×3)÷2可得:2NH3(g)?N2(g)+3H2(g),△H=+92.4 kJ•mol-1;
如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,平衡时的反应热为92.4kJ,说明反应的氨气为2mol,则:
2NH3(g)?N2(g)+3H2(g)
起始量(mol):3 0 0
变化量(mol):2 1 3
平衡量(mol):1 1 3
根据v=$\frac{△c}{△t}$计算v(H2);
保持温度不变,平衡常数不变,根据K=$\frac{c({N}_{2})×{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$计算平衡常数,将起始NH3的物质的量调整为8mol,设转化的氨气物质的量为xmol,表示出平衡时各组分物质的量,再结合平衡常数列方程计算解答;
(2)氨气在纯氧中燃烧,生成一种单质和水,应生成氮气与水;
氨气--氧气燃料电池,燃料在负极发生氧化反应,则通入氨气的电极是负极,碱性条件下,生成氮气与水;
(3)a.增大压强,反应速率增大,平衡向气体体积减小的方向移动;
b.适当升高温度,反应速率增大,平衡向吸热反应移动;
c.增大反应物氧气的浓度,平衡正向进行,反应速率增大;
d.选择高效催化剂只能改变化学反应速率,但不影响化学平衡;
(4)溶液中c(Mg2+)=0.01mol/L,根据溶度积常数Ksp=c(Mg2+)×c2(OH-)=4.0×10-12 ,计算c(OH-),氨水的浓度=$\frac{c(O{H}^{-})}{氨水电离度}$.
解答 解:(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
依据盖斯定律,(②-①×2-③×3)÷2可得:2NH3(g)?N2(g)+3H2(g),△H=+92.4 kJ•mol-1;
如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,平衡时的反应热为92.4kJ,说明反应的氨气为2mol,则:
2NH3(g)?N2(g)+3H2(g)
起始量(mol):3 0 0
变化量(mol):2 1 3
平衡量(mol):1 1 3
v(H2)=$\frac{\frac{3mol}{1L}}{2min}$=1.5mol/(L.min);
平衡常数K=$\frac{c({N}_{2})×{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$=$\frac{1×{3}^{3}}{{1}^{2}}$=27,保持温度不变,平衡常数不变,将起始NH3的物质的量调整为8mol,设转化的氨气物质的量为xmol,则:
2NH3(g)?N2(g)+3H2(g)
起始量(mol):8 0 0
变化量(mol):x 0.5x 1.5x
平衡量(mol):8-x 0.5x 1.5x
则$\frac{0.5x×(1.5x)^{3}}{(8-x)^{2}}$=27,解得x=4 平衡时氨气的转化率=$\frac{4mol}{8mol}$×100%=50%
故答案为:2NH3(g)?N2(g)+3H2(g)△H=+92.4 kJ•mol-1;1.5mol/(L.min);50%;
(2)氨气在纯氧中燃烧,生成一种单质和水,应生成氮气与水,反应的化学方程式:4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O;
氨气--氧气燃料电池,燃料在负极发生氧化反应,则通入氨气的电极是负极,碱性条件下生成氮气与水,该电极发生反应的电极反应式为:2NH3+6OH--6e-=N2+6H2O,
故答案为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,负极;2NH3+6OH--6e-=N2+6H2O;
(3)a.反应是气体体积增大的反应,增大压强,反应速率增大,平衡逆向进行,故a不符合;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行,故b不符合;
c.增大O2的浓度,平衡正向进行,反应速率增大,故c符合;
d.选择高效催化剂只能改变化学反应速率,但不改变化学平衡,故d不符合;
故答案为:c;
(4)如果某氨水的电离程度为1%,浓度为0.01mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),{已知Ksp[Mg(OH)2]=4.0×10-12]},则依据
溶度积常数Ksp=c(Mg2+)×c2(OH-)=4.0×10-12 ,溶液中c(Mg2+)=0.01mol/L,则c(OH-)=2×10-5mol/L,氨水的浓度=$\frac{2×1{0}^{-5}mol/L}{1%}$=0.002mol/L,
故答案为:0.002 mol/L.
点评 本题考查化学平衡计算与影响因素、热化学方程式书写、原电池、溶度积有关计算等,是对学生综合能力的考查,注意对基础知识的理解掌握与灵活应用,难度中等.


 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 将一氧化碳中毒者移到通风处抢救 | |
| B. | 眼睛里不慎溅进了药液,应立即用水冲洗,并且用手使劲揉眼睛 | |
| C. | 不慎将浓硫酸溅到皮肤上,应立即用大量水冲洗 | |
| D. | 不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Ag+、Cl- | B. | Ca2+、NO3-、Mg2+ | C. | Na+、CO32-、Fe2+ | D. | Cu2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( ) | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.1 mol/(L•min) | |
| B. | T1<T2,正反应为吸热反应 | |
| C. | 平衡时保持温度不变,缩小容器体积平衡向正反应方向移动 | |
| D. | T1℃时,若起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
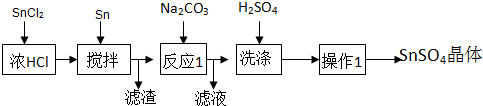
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
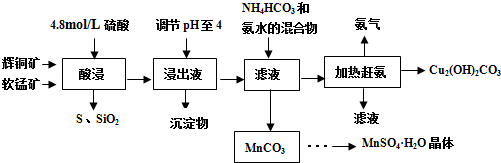
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10mL量筒量取8.58mL蒸馏水 | |
| C. | 制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com