
| A、NH3?H2O═NH4++OH- |
| B、KClO3═K++Cl-+3O2- |
| C、CH3COOH═CH3COO-+H+ |
| D、NaOH═Na++OH- |


科目:高中化学 来源: 题型:
| A、仅①③④⑤ | B、仅②③④ |
| C、仅①③④ | D、仅①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生有效碰撞的分子一定是活化分子 |
| B、活化分子间的碰撞一定是有效碰撞 |
| C、能发生有效碰撞的分子必须具有相当高的能量 |
| D、使用催化剂能改变分子的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 |
| B、使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 |
| C、清晨,在茂密的树林中,常常可以看到枝叶间透过的一道道光线 |
| D、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2Br-═2Cl-+Br2 |
| B、2Fe2++Cl2═2Fe3++2Cl- |
| C、2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
| D、2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有一瓶澄清溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、Mg2+、I-、NO3-、CO32-、SO42-、AlO2-.取该溶液进行以下实验:
有一瓶澄清溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、Mg2+、I-、NO3-、CO32-、SO42-、AlO2-.取该溶液进行以下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| 常温下 |
| SO2 |
| A、MFe2Ox是还原剂 |
| B、SO2是该反应的催化剂 |
| C、X>Y |
| D、氧化性:MFe2Ox>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
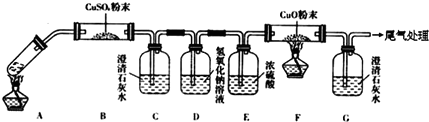
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com