
| ||
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中:Na+、MnO4-、SO42-、K+ |
| B、使蓝色石蕊试纸变红的溶液中:K+、S2-、NO3-、OH- |
| C、加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl- |
| D、含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 条件的变化 | 升温 | 通氨气 | 加水 | 加NaOH(s) | 加NH4Cl(s) | 通CO2 |
| 电离平衡移动的方向 | ||||||
| n(OH-) | ||||||
| c(OH-) | ||||||
| c(NH3?H2O) | ||||||
| 导电能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0 | 20 | 40 | 60 | 80 | |
| c(N2O4)mol?L-1 | 0.100 | a | 0.050 | c | d |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | b | 0.120 | 0.120 |
查看答案和解析>>
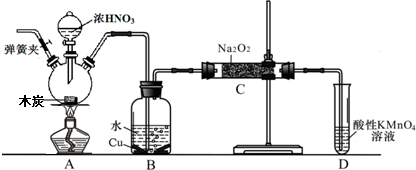
科目:高中化学 来源: 题型:
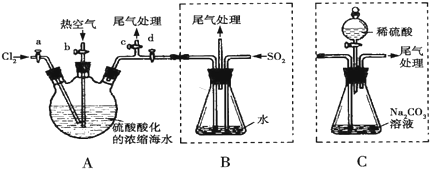
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2与F2反应的热化学方程式为:H2(g)+F2(g)=2HF(g);△H=-541 kJ |
| B、2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C、在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
| D、1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com