
 ��д��ˮ���ӵĵ���ʽ
��д��ˮ���ӵĵ���ʽ ��
������ ��1��������ԭ�Ӻ�����3�����Ӳ㣬����������Ϊ8��ˮΪ���ۻ����
��2��NH4NO3Ϊ���ӻ����
��3���������������Ʒ�Ӧ�����Ȼ��ơ��������ƺ�ˮ��
��4�������Ȼ�����Ӧ�����Ȼ�������
��5���γ�ԭ��ط�Ӧʱ����Ϊ������������Ϊ̼�����������ҺΪ�Ȼ����������������������������ӱ���ԭ��
��� �⣺��1��������ԭ�Ӻ�����3�����Ӳ㣬����������Ϊ8�����ӽṹʾ��ͼΪ ��H2O�ǹ��ۻ��������ԭ�Ӻ���ԭ���γɹ��ۼ�������ʽΪ
��H2O�ǹ��ۻ��������ԭ�Ӻ���ԭ���γɹ��ۼ�������ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
��
��2��NH4NO3Ϊ��Σ��������ӻ�����ʴ�Ϊ�����ӣ�
��3���������������Ʒ�Ӧ�����Ȼ��ơ��������ƺ�ˮ�����ӷ���ʽ��Cl2+2OH-=Cl?+ClO-+H2O���ʴ�Ϊ��Cl2+2OH-=Cl?+ClO-+H2O��
��4�������Ȼ�����Ӧ�����Ȼ���������Ӧ�����ӷ���ʽΪFe+2Fe3+=3Fe2+���ʴ�Ϊ��Fe+2Fe3+=3Fe2+��
��5��ʯī--�����Ȼ����������Һ���γ�ԭ��أ�ʯīΪ������Fe3+�������ϵõ��ӱ���ԭ���缫��ӦʽΪ��2Fe3++2e-=2Fe2+�������������缫��ӦʽΪFe-2e-=Fe2+�������ɸ���������������������ԭ���װ��ͼΪ��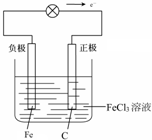 ��
��
�ʴ�Ϊ��2Fe3++2e-=2Fe2+��Fe-2e-=Fe2+�� ��
��
���� �����ۺϿ���Ԫ�ػ������ԭ��ء����û�ѧ���Ϊ��Ƶ���㣬��Ŀ�Ѷ��еȣ�ע��ԭ���װ��ͼ�Ļ滭�Լ�ԭ��صĹ���ԭ��������������ʵ����ʣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | n=m+1 | B�� | n=m+10 | C�� | n=m+11 | D�� | n=m+25 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʹ pH ��ֽ�ʺ�ɫ����Һ��Fe2+��NH4+��Cl-��NO3- | |
| B�� | pH=13����Һ��S2-��SO32-��SO42-��Na+ | |
| C�� | ʹ��ɫʯ����ֽ����ɫ����Һ��K+��HCO3-��Br-��Ba2+ | |
| D�� | ��������ΪK2SO4����Һ��AlO2-��Na+��Al3+��Ba2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 Ԫ�������ڱ��е�λ�ã���ӳ��Ԫ�ص�ԭ�ӽṹ��Ԫ�ص����ʣ���ͼ��Ԫ�����ڱ���һ���֣�
Ԫ�������ڱ��е�λ�ã���ӳ��Ԫ�ص�ԭ�ӽṹ��Ԫ�ص����ʣ���ͼ��Ԫ�����ڱ���һ���֣� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | �� |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol Al3+���еĺ��������Ϊ3��6.02��1023 | |
| B�� | ��58.5 g NaCl����1.00 Lˮ�У�����NaCl��Һ��Ũ��Ϊ1.00 mol•L-1 | |
| C�� | 2 mol SO2������������O2��һ�������·�Ӧ��ת�Ƶĵ�����Ϊ4��6.02��1023 | |
| D�� | �����£�100mL pH=1��������Һ�к��е�H+������Ϊ0.01��6.02��1023 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AgCl�ڱ���NaCl��Һ�е�KSP���ڴ�ˮ�е�KSPС | |
| B�� | KSP��AgCl����KSP��Ag2CrO4������˵��Ag2CrO4��AgCl������ˮ | |
| C�� | ��0.00lmol•L-1AgNO3��Һ����0.001 mol•L-1KC1��0.00lmol•L-1K2CrO4�����Һ�У��Ȳ���Ag2CrO4���� | |
| D�� | ͬAgCl������Һ�еμ�Ũ��ˮ������ܽ⣬����Ϊ�������������Ӷ�ʹAgCl���ܽ�ƽ�������ƶ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com