
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
分析 X的一种1:2型氢化物分子中既有σ键又有π键,说明分子里有双键或参键,且所有原子共平面,所以X为C元素,它的1:2型氢化物为乙烯;Z的L层上有2个未成对电子,即核外电子排布为1s22s22p2或1s22s22p4,X、Y、Z原子序数依次增大,所以Z为O元素,Y的原子序数介于碳、氧之间,则Y为N元素;Q原子s能级与p能级电子数相等,则Q的核外电子排布为1s22s22p4或1s22s22p63s2,由于Q的原子序数比Z大,所以Q的电子排布为1s22s22p63s2,即Q为Mg元素;而G的原子序数介于氧和镁元素之间,所以G为Na元素;R单质是制造各种计算机、微电子产品的核心材料,R为Si元素;T处于周期表的ds区,且最外层只有一个电子,则T为Cu,以此来解答.
解答 解:X的一种1:2型氢化物分子中既有σ键又有π键,说明分子里有双键或参键,且所有原子共平面,所以X为C元素,它的1:2型氢化物为乙烯;Z的L层上有2个未成对电子,即核外电子排布为1s22s22p2或1s22s22p4,X、Y、Z原子序数依次增大,所以Z为O元素,Y的原子序数介于碳、氧之间,则Y为N元素;Q原子s能级与p能级电子数相等,则Q的核外电子排布为1s22s22p4或1s22s22p63s2,由于Q的原子序数比Z大,所以Q的电子排布为1s22s22p63s2,即Q为Mg元素;而G的原子序数介于氧和镁元素之间,所以G为Na元素;R单质是制造各种计算机、微电子产品的核心材料,R为Si元素;T处于周期表的ds区,且最外层只有一个电子,则T为Cu.
(1)Y为氮元素,核外电子排布式为1s22s22p3,所以7种不同运动状态的电子,T为Cu元素,它的核外电子排布式为1s22s22p63s23p63d104s1,有7种不同原子轨道的电子,故答案为:7;7;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,能量较低,第一电离能高于氧元素的,故第一电离能由小到大的顺序为:C<O<N,
故答案为:C<O<N;
(3)OCN-与CO2互为等电子体,所以它们结构相似,在二氧化碳中碳的价层电子对数为:$\frac{4}{2}$=2,所以碳的杂化方式为sp杂化,
故答案为:sp杂化;
(4)化合物甲为二氧化硅,在二氧化硅晶体中,每个硅原子周围有四个Si-O 键,所以1mol二氧化硅中含有4molSi-O 键,SiO2与HF反应的方程式为:SiO2+4HF=SiF4+2H2O,其中SiF4中硅原子的价层电子对数为4+$\frac{4-1×4}{2}$=4,没有孤电子对,所以SiF4的空间构型为正四面体,H2O中氧原子的价层电子对数为2+$\frac{6-1×2}{2}$4,有2对孤电子对,所以H2O的空间构型为V形,
故答案为:4;SiF4为正四面体形;H2O为V形;
(5)在NaF、MgF2、SiF4中NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高,
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高;
(6)向硫酸铜溶液中逐滴加入氨水至过量,开始生成氢氧化铜沉淀,后来沉淀溶解生成四氨合铜离子,其反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2 NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
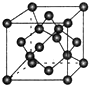
(7)C单质的晶胞如图所示,在顶点上8个原子,面心上2个原子,晶体内部为4个原子,所以一个C晶胞中原子数为:$\frac{1}{8}$×8+$\frac{1}{2}$×6+4=8;设晶体中最近的两个X原子之间的距离为xcm,晶胞的边长为acm,则a3=$\frac{{\frac{12×8}{N_A}}}{p}$,由晶胞图可知a2+a2=(4x•sin$\frac{109°28′}{2}$)2,所以2×$\root{3}{{\frac{12}{{p{N_A}}}}}$=2$\sqrt{2}$x•sin$\frac{109°28′}{2}$,解得x=$\frac{\sqrt{2}×\root{3}{\frac{12}{ρ{N}_{A}}}}{2sin\frac{109°28′}{2}}$,
故答案为:8;$\frac{\sqrt{2}×\root{3}{\frac{12}{ρ{N}_{A}}}}{2sin\frac{109°28′}{2}}$.
点评 本题考查晶胞计算及原子结构与元素周期律,为高频考点,把握原子结构、电子排布、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意(7)中计算为解答的难点,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| B. | NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-=AlO2-+2H2O | |
| C. | Na2SiO3溶液与稀盐酸混合:Na2SiO3+2H+=2Na++H2SiO3↓ | |
| D. | Ca(HCO3)2溶液和Ca(OH)2溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
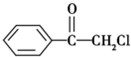 (1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图 所示:则苯氯乙酮不可能具有的化学性质是ABD(填字母序号)
(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图 所示:则苯氯乙酮不可能具有的化学性质是ABD(填字母序号)
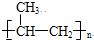 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molN2和1molCO所含的分子数都是NA | |
| B. | 1molH2和1molCO2所含的原子数都是NA | |
| C. | 1molCO和1molCO2所含的氧原子数都是NA | |
| D. | 1molH2SO4和1molH3PO4所含的原子数都是4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在潮湿的空气中易腐蚀 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | 往往需要在催化剂条件下SO2氧化成SO3 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com